Ацетангидрид
Содержание:
- Примечания
- Химические свойства
- Химические свойства
- Химические свойства
- Производство
- Ангидриды карбоновых кислот
- Лабораторные методы получения
- Получение
- Лабораторные методы получения
- Лабораторные методы получения
- Химические свойства
- Примечания[ | код]
- Физические свойства
- Реакции
- Лабораторные методы получения
- Лабораторные методы получения
- Физические и химические свойства
- Применение — уксусный ангидрид
Примечания
- Мяделец М. А., Домрачев Д. В., Черемушкина В. А. . Дата обращения 28 февраля 2016.
- . Дата обращения 28 февраля 2016.
- Зыкова И. Д., Ефремов А. А. . Дата обращения 28 февраля 2016.
- Горяев М. И. . Дата обращения 28 февраля 2016.
- Урсул О. Н., Алексанян К. А., Ткачук Л. А. . журнал «Пищевая промышленность: наука и технологии», Минск, ISSN 2073-4794 (1 ноября 2012). Дата обращения 28 февраля 2016.
- ↑ , с. 107.
- ↑ , с. 186.
- ↑ , с. 155.
- Козлов П.В., Герц И.Б. . М., «Искусство» (1965). Дата обращения 28 февраля 2016.
- «Кинетика щелочного гидролиза метилацетата, бутилацетата и изобутилацетата в растворах вода-ацетонитрил» / М. Ю. Панов, О. Б. Соколова // Журнал физической химии . — 15/07/1997 . — Т. 71, N 7 . — 1199—1203
- Менделеев Д. И., Монастырский Д. Н. Эфиры сложные // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Павлов Б.А., Терентьев А.П. . М., «Химия» (1965). Дата обращения 28 февраля 2016.
- . Дата обращения 28 февраля 2016.
- ↑ , с. 107-108.
- ↑ , с. 108.
- , p. 244.
- . Москва (15.06.2003 с изменениями от 26.05.2008). Дата обращения 28 февраля 2016.
- . БГУ. Дата обращения 28 февраля 2016. (недоступная ссылка)
- . Дата обращения 28 февраля 2016.
Химические свойства
Уксусный ангидрид часто применяется в реакциях ацилирования (в данном случае, ацетилирования), в которые вступает широкий ряд различных соединений.
- В частности, в реакцию с уксусным ангидридом вступают спирты, при этом выделяется уксусная кислота, а катализаторами выступают основания (например, ацетат натрия) и сильные кислоты.
- В реакции ацилирования вступают также амины, причём для них эта реакция протекает быстрее, чем для спиртов. Анилины также можно ацетилировать: обычно такая реакция применяется для защиты аминогруппы, соединённой с ароматическим циклом от окисления.
- Уксусный ангидрид используется для ацилирования ароматических углеводородов по реакции Фриделя — Крафтса, например, при реакции бензола с уксусным ангидридом в присутствии катализатора образуется ацетофенон.
- Реакции ацетилирования подвергаются также неорганические кислоты. Так, при взаимодействии уксусного ангидрида с азотной кислотой образуется ацетилнитрат — нитрующий реагент, находящий применение в тонком органическом синтезе. Также смешанные эфиры с уксусным ангидридом дают серная кислота, сульфоновые кислоты и соляная кислота.
- Ацетилированию могут подвергаться также оксиды с образованием соответствующих ацетатов. С уксусным ангидридом реагируют также различные соли, ацетилениды, алкоголяты.
- Пероксиды под действием уксусного ангидрида образуют надуксусную кислоту (пероксид водорода) либо перекись ацетила (CH3CO)2O2.
Другим важным свойством уксусного ангидрида является его способность отнимать воду в химических реакциях. Данное свойство широко используется в органическом синтезе, а также химической промышленности. В частности, уксусный ангидрид используется как водоотнимающее средство при получении гексогена. Также под действием уксусного ангидрида оксимы теряют воду, превращаясь в нитрилы. Кроме того, уксусный ангидрид участвует во многих реакциях циклизации.
Уксусный ангидрид вступает в реакцию Перкина и другие реакции карбонильных соединений.
Химические свойства
Уксусный ангидрид часто применяется в реакциях ацилирования (в данном случае, ацетилирования), в которые вступает широкий ряд различных соединений.
- В частности, в реакцию с уксусным ангидридом вступают спирты, при этом выделяется уксусная кислота, а катализаторами выступают основания (например, ацетат натрия) и сильные кислоты.
- В реакции ацилирования вступают также амины, причём для них эта реакция протекает быстрее, чем для спиртов. Анилины также можно ацетилировать: обычно такая реакция применяется для защиты аминогруппы, соединённой с ароматическим циклом от окисления.
- Уксусный ангидрид используется для ацилирования ароматических углеводородов по реакции Фриделя — Крафтса, например, при реакции бензола с уксусным ангидридом в присутствии катализатора образуется ацетофенон.
- Реакции ацетилирования подвергаются также неорганические кислоты. Так, при взаимодействии уксусного ангидрида с азотной кислотой образуется ацетилнитрат — нитрующий реагент, находящий применение в тонком органическом синтезе. Также смешанные эфиры с уксусным ангидридом дают серная кислота, сульфоновые кислоты и соляная кислота.
- Ацетилированию могут подвергаться также оксиды с образованием соответствующих ацетатов. С уксусным ангидридом реагируют также различные соли, ацетилениды, алкоголяты.
- Пероксиды под действием уксусного ангидрида образуют надуксусную кислоту (пероксид водорода) либо перекись ацетила (CH3CO)2O2.
Другим важным свойством уксусного ангидрида является его способность отнимать воду в химических реакциях. Данное свойство широко используется в органическом синтезе, а также химической промышленности. В частности, уксусный ангидрид используется как водоотнимающее средство при получении гексогена. Также под действием уксусного ангидрида оксимы теряют воду, превращаясь в нитрилы. Кроме того, уксусный ангидрид участвует во многих реакциях циклизации.
Уксусный ангидрид вступает в реакцию Перкина и другие реакции карбонильных соединений.
Химические свойства
По химическим свойствам метилацетат представляет собой типичный сложный эфир алифатической монокарбоновой кислоты.
Легко гидролизуется (омыляется) на исходные спирт и кислоту водой (обратимо) или щелочами (необратимо, так как образующаяся карбоновая кислота превращается в соль):
- CH3COOCH3+H2O → CH3COOH+CH3OH{\displaystyle \mathrm {CH_{3}COOCH_{3}+H_{2}O\ \rightarrow \ CH_{3}COOH+CH_{3}OH} }
Восстановление метилацетата приводит к образованию двух спиртов (этанол и метанол):
- CH3COOCH3+2H2 → CH3CH2OH+CH3OH{\displaystyle \mathrm {CH_{3}COOCH_{3}+2H_{2}\ \rightarrow \ CH_{3}CH_{2}OH+CH_{3}OH} }
Под действием аммиака метилацетат превращается в ацетамид и метанол:
- CH3COOCH3+NH3 → CH3CONH2+CH3OH{\displaystyle \mathrm {CH_{3}COOCH_{3}+NH_{3}\ \rightarrow \ CH_{3}CONH_{2}+CH_{3}OH} }
Производство
Уксусный ангидрид сначала синтезировался в 1852 французским химиком Шарлем Фредерик Герхардтом (1816-1856), нагревая ацетат калия с benzoyl хлоридом.
Уксусный ангидрид произведен carbonylation ацетата метила:
: CHCOCH + CO → (CHCO) O
Теннесси Истмэн уксусный процесс ангидрида включает преобразование ацетата метила к йодиду метила и ацетатной соли. Carbonylation йодида метила в свою очередь предоставляет йодид ацетила, который реагирует с ацетатными солями или уксусной кислотой, чтобы дать продукт. Хлорид родия в присутствии литиевого йодида используется как катализаторы. Поскольку уксусный ангидрид не стабилен в воде, преобразование проводится при безводных условиях.
До уменьшающейся степени уксусный ангидрид также подготовлен реакцией ketene (ethenone) с уксусной кислотой в 45–55 °C и низком давлении (0.05–0.2 бара).
:HC=C=O + CHCOOH → (CHCO) O (ΔH = −63 kJ/mol)
Ketene произведен, обезводив уксусную кислоту в 700–750 °C в присутствии triethyl фосфата как катализатор или (в Швейцарии и СНГ) thermolysis ацетона в 600–700 °C в присутствии углеродного дисульфида как катализатор.
:CHCOOH HC=C=O + HO (ΔH = +147 кДж/молекулярные массы)
:CHCOCH → HC=C=O + CH
Маршрут от уксусной кислоты до уксусного ангидрида через ketene был развит Вакер Чеми в 1922, когда спрос на уксусный ангидрид увеличился из-за производства ацетата целлюлозы.
Из-за его низкой стоимости, уксусный ангидрид куплен, не подготовлен для использования в научно-исследовательских лабораториях.
Ангидриды карбоновых кислот
Классификация. Номенклатура
Ангидриды являются продуктами дегидратации карбоновых кислот. Различают линейные и циклические ангидриды карбоновых кислот: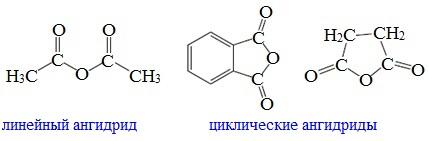
Линейные ангидриды, в молекулу которых входят остатки разных кислот, в том числе и минеральных, называются смешанными ангидридами.
Названия ангидридов образуют из тривиальных названий соответствующих кислот:
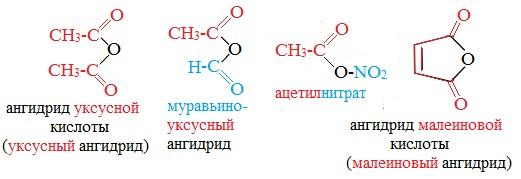
Способы получения
1. Дегидратация карбоновых кислот
Линейный ангидриды можно получить из карбоновых кислот при взаимодействии с сильными водоотнимающими реагентами (P2O5, ангидрид трифторуксусной кислоты С4F6O3).Циклические ангидриды получают отщеплением воды от дикарбоновых кислот при их нагревании: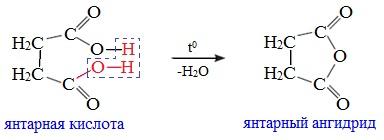
2. Взаимодействием галогенангидридов с солями карбоновых кислот
Линейные ангидриды получают взаимодействием хлорангидридов с натриевыми или калиевыми солями карбоновых кислот: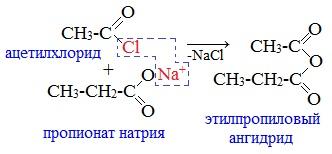
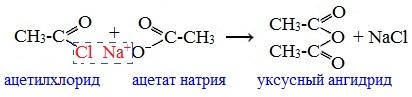
3. Взаимодействие карбоновых кислот с кетенами
Ангидриды получают при взаимодействии карбоновых кислот с кетенами:
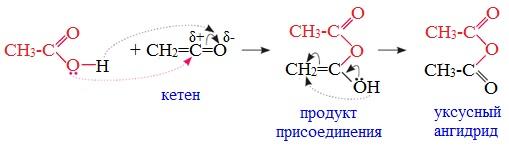
Данный метод используется в промышленности для получения уксусного ангидрида.
Первый представитель гомологического ряда – ангидрид муравьиной кислоты – нестабилен.
Физические свойства
Ангидриды карбоновых кислот представляют собой бесцветные жидкости или кристаллические вещества. Низшие представители гомологического ряда обладают раздражающим запахом. Ангидриды карбоновых кислот малорастворимы в воде и медленно с ней реагируют.
Характеристика реакционной способности
Ангидриды карбоновых кислот, подобно галогенангидридам, являются весьма активными электрофильными реагентами. Связи в молекулах ангидридов карбоновых кислот сильно поляризованы.
Ангидриды карбоновых кислот имеют менее выраженный электрофильный характер, чем галогенангидриды, но проявляют большую электрофильность по сравнению с карбоновыми кислотами, поскольку у них атом кислорода, проявляющий +М-эффект, приходится на две ацильные группы:
Ангидриды карбоновых кислот легко реагируют с различными нуклеофильными реагентами и используются для введения в их структуру ацильных групп.
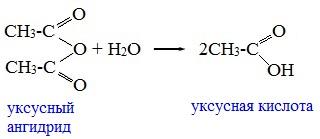
Химические свойства
1. Взаимодействие с водой (гидролиз)
При взаимодействии с водой ангидриды медленно гидролизуются с образованием соответствующих кислот:
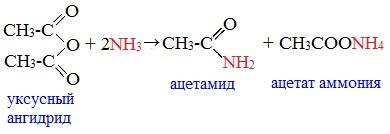
2. Взаимодействие с аммиаком (аммонолиз)
При взаимодействии линейных ангидридов с аммиаком, первичными или вторичными аминами образуются амиды карбоновых кислот:
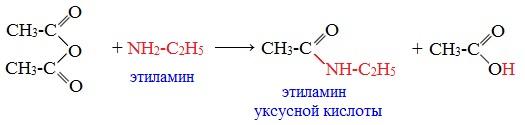
Циклические ангидриды реагируют с аммиаком и первичными аминами с образованием неполных амидов дикарбоновых кислот, которые при нагревании циклизуются в имиды:
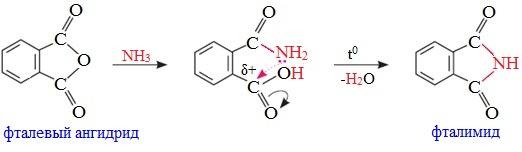
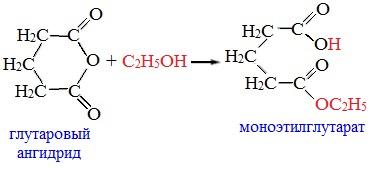
3. Взаимодействие со спиртами (алкоголиз)
При обработке линейных ангидридов спиртами образуются сложные эфиры:
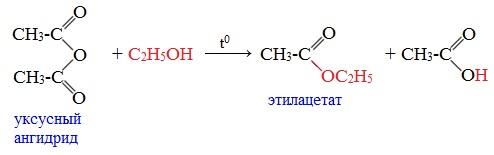
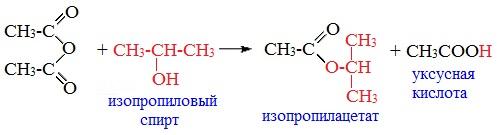
Циклические ангидриды реагируют со спиртами с образованием неполных (кислых) эфиров дикарбоновых кислот:
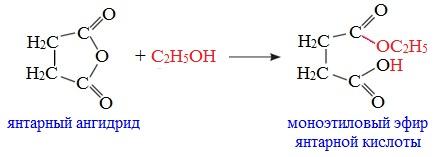
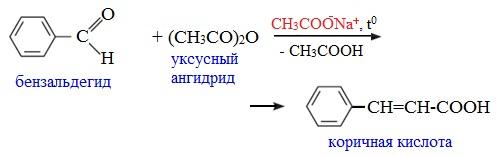
4. Реакции α-водородного атома
Как и в случае карбоновых кислот, в молекулах ангидридов атомы водорода при α-углеродных атомах подвижны. С участием связи С-Н в α-положении ангидриды карбоновых кислот в присутствии оснований (соли карбоновых кислот, третичные амины) вступают в реакцию конденсации с ароматическими альдегидами, образуя ненасыщенные аренкарбоновые кислоты.
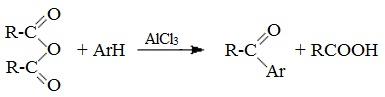
5. Образование ароматических кетонов
При взаимодействии ангидридов с аренами в присутствии хлорида алюминия образуются кетоны (реакция Фриделя-Крафтса):
Отдельные представители
Уксусный ангидрид (CH3CO)2O — бесцветная жидкость с резким запахом (т.кип.140С), раздражает слизистые оболочки глаз и дыхательных путей, вызывает ожоги кожи. С водой медленно реагирует, образуя уксусную кислоту, растворяется в этаноле, эфире, бензоле, уксусной кислоте.
Применяется в качестве ацетилирующего реагента в производстве ацетилцеллюлозы, винилацетата, диметилацетамида, лекарственных средств (ацетилсалициловой кислоты и др.).
Фталевый ангидрид — белое кристаллическое вещество (т.пл.130,8С), легко возгоняется, растворим в этаноле. Обладает свойствами ароматических соединений. Легко реагирует с фенолами и их производными.
Используют в синтезе лекарственных препаратов (фталазол, фтазин и др.), в производстве алкидных смол, пластификаторов, красителей.
Рубрики: ОРГАНИЧЕСКАЯ ХИМИЯ
Лабораторные методы получения
В лаборатории уксусный ангидрид получают по реакции ацетилхлорида с безводным ацетатом натрия. Также применяют реакцию уксусной кислоты с неорганическими ангидридами и хлорангидридами (SO2Cl2, SOCl2, COCl2, N2O4, POCl3).
Очистка в лабораторных условиях
Уксусный ангидрид достаточной степени очистки обычно можно получить перегонкой с эффективным дефлегматором. Примеси уксусной кислоты удаляют кипячением с карбидом кальция CaC2 или нагреванием с магниевой стружкой (80—90 °С, 5 дней). Осушение уксусного ангидрида проводят над натриевой проволокой в течение недели. Также уксусный ангидрид можно очистить азеотропной перегонкой с толуолом. Быстрый метод очистки заключается во встряхивании уксусного ангидрида с P2O5, затем с карбонатом калия и фракционной перегонке.
Получение
Метилацетат получают:
этерификацией уксусной кислоты метанолом в жидкой фазе в присутствии серной кислоты (или при пропускании смеси паров указанных жидкостей над нагретыми катализаторами: FeCl3, AlCl3):
- CH3COOH+CH3OH → CH3COOCH3+H2O{\displaystyle \mathrm {CH_{3}COOH+CH_{3}OH\ \rightarrow \ CH_{3}COOCH_{3}+H_{2}O} }
из уксусного ангидрида и метанола (реакция протекает в жидкой фазе в отсутствии катализатора и является практически необратимой):
- (CH3CO)2O+CH3OH → CH3COOCH3+CH3COOH{\displaystyle \mathrm {(CH_{3}CO)_{2}O+CH_{3}OH\ \rightarrow \ CH_{3}COOCH_{3}+CH_{3}COOH} },
по реакции Байера-Виллигера воздействием перкарбоновой кислоты на ацетон в присутствии кислот Льюиса как катализатора (например, BF₃):
- (CH3)2CO+RC(O)OOH →H+ CH3COOCH3{\displaystyle \mathrm {(CH_{3})_{2}CO+RC(O)OOH\ {\xrightarrow {H^{+}}}\ CH_{3}COOCH_{3}} },
кроме синтетических методов — пиролизом древесины.
Лабораторные методы получения
В лаборатории уксусный ангидрид получают по реакции ацетилхлорида с безводным ацетатом натрия. Также применяют реакцию уксусной кислоты с неорганическими ангидридами и хлорангидридами (SO2Cl2, SOCl2, COCl2, N2O4, POCl3).
Очистка в лабораторных условиях
Уксусный ангидрид достаточной степени очистки обычно можно получить перегонкой с эффективным дефлегматором. Примеси уксусной кислоты удаляют кипячением с карбидом кальция CaC2 или нагреванием с магниевой стружкой (80—90 °С, 5 дней). Осушение уксусного ангидрида проводят над натриевой проволокой в течение недели. Также уксусный ангидрид можно очистить азеотропной перегонкой с толуолом. Быстрый метод очистки заключается во встряхивании уксусного ангидрида с P2O5, затем с карбонатом калия и фракционной перегонке.
Лабораторные методы получения
В лаборатории уксусный ангидрид получают по реакции ацетилхлорида с безводным ацетатом натрия. Также применяют реакцию уксусной кислоты с неорганическими ангидридами и хлорангидридами (SO2Cl2, SOCl2, COCl2, N2O4, POCl3).
Очистка в лабораторных условиях
Уксусный ангидрид достаточной степени очистки обычно можно получить перегонкой с эффективным дефлегматором. Примеси уксусной кислоты удаляют кипячением с карбидом кальция CaC2 или нагреванием с магниевой стружкой (80—90 °С, 5 дней). Осушение уксусного ангидрида проводят над натриевой проволокой в течение недели. Также уксусный ангидрид можно очистить азеотропной перегонкой с толуолом. Быстрый метод очистки заключается во встряхивании уксусного ангидрида с P2O5, затем с карбонатом калия и фракционной перегонке.
Химические свойства
Гидролиз
При действии горячей воды или водного пара амиды гидролизуются. Реакция протекает медленно, поскольку вода обладает низкой реакционной способностью по отношению к амидам: некоторые амиды даже перекристаллизовывают из неё. Гидролизу способствует щелочная либо кислая среда: в первом случае атаку на амид осуществляет более нуклеофильный гидроксид-ион OH-, а во втором случае амид протонируется по атому кислорода, из-за чего амидная группа становится более восприимчивой к атаке.
- RCONH2+H2O→RCOOH+NH3{\displaystyle {\mathsf {RCONH_{2}+H_{2}O\rightarrow RCOOH+NH_{3}}}}
Почти все амиды гидролизуются в щелочной среде. Реакция ускоряется, если в амиде присутствуют электроноакцепторные группы, и замедляется при наличии пространственных затруднений. Катализ может осуществляться не обязательно протоном или гидроксид-ионом: возможен и общий кислотно-основный катализ.
Восстановление
Амиды устойчивы к восстановлению, и лишь сильные восстановители (гидриды, натрий в жидком аммиаке и электролиз) вступают с ними в реакции. При обработке первичных амидов алюмогидридом лития в диэтиловом эфире или тетрагидрофуране они восстанавливаются до первичных аминов. Аналогично, вторичные амиды дают вторичные амины, а третичные амиды — третичные амины. Лактамы в этих условиях дают циклические амины. Также в этих реакциях можно использовать диборан и электролиз.
- RCONR2→RCH2NR2{\displaystyle {\mathsf {RCONR_{2}\rightarrow RCH_{2}NR_{2}}}}
N,N-Диалкиламиды можно контролируемо восстановить до альдегидов: в этом случае вместо алюмогидрида лития удобнее использовать более слабый восстановитель триэтоксиалюмогидрид лития LiAlH(OEt)3, получаемый из LiAlH4 и этанола. Также такое восстановление можно провести под действием гидрида диизобутилалюминия и натрия в жидком аммиаке.
- RCONR2→RCHO+R2NH→RCH2OH+R2NH{\displaystyle {\mathsf {RCONR_{2}\rightarrow RCHO+R_{2}NH\rightarrow RCH_{2}OH+R_{2}NH}}}
Дегидратация
Первичные амиды отщепляют воду, давая нитрилы, под действием хлористого тионила, оксалилхлорида и оксихлорида фосфора. Наилучшим вариантом считается использование хлористого тионила в ДМФА. Также с этой целью используют трифторуксусный ангидрид в присутствии пиридина.
Нитрозирование
Первичные амиды легко разлагаются на холоде раствором азотистой кислоты, при этом выделяется азот и образуется соответствующая карбоновая кислота. В практическом плане преимущество имеют алкилнитриты RONO и тетрафторборат нитрозония NO+BF4-. Вторичные амиды, по аналогии с аминами, дают N-нитрозоамиды.
- RCONH2+HNO2→RCOOH+H2O+N2{\displaystyle {\mathsf {RCONH_{2}+HNO_{2}\rightarrow RCOOH+H_{2}O+N_{2}}}}
Галогенирование и перегруппировка Гофмана
Первичные и вторичные амиды реагируют с NaOCl, NaOBr, давая соответствующие N-хлорамиды или N-бромамиды. Сами эти соединения являются селективными галогенирующими реагентами (типичным примером является N-бромсукцинимид). Также N-галогенамиды в избытке щёлочи вступают в перегруппировку Гофмана, отщепляя при этом молекулу CO2 и давая амин, имеющий на один атом углерода меньше, чем исходный амид.
Реакции с металлоорганическими реагентами
Металлоорганические соединения, такие как реактивы Гриньяра и алкиллитиевые реагенты, могут присоединяться к карбонильной группе амида. Такие реакции с первичными и вторичными амидами бесполезны, поскольку реагент взаимодействует с кислым протоном при атоме азота и превращается в соответствующий алкан. Третичные амиды дают с реактивами Гриньяра прочные продукты присоединения, которые при обработке водной кислотой дают кетоны. Диметилформамид даёт соответствующий альдегид.
- RCONMe2+R′MgX→RR′C(NMe2)OMgX→RCOR′+MgX2+Me2NH{\displaystyle {\mathsf {RCONMe_{2}+R’MgX\rightarrow \rightarrow RCOR’+MgX_{2}+Me_{2}NH}}}
При использовании избытка реактива Гриньяра происходит формальное замещение карбонильного атома кислорода двумя алкильными группами.
- HCONMe2+2RMgX→R2CHNMe2+MgO+MgX2{\displaystyle {\mathsf {HCONMe_{2}+2RMgX\rightarrow R_{2}CHNMe_{2}+MgO+MgX_{2}}}}
Кислотно-основные свойства
Амиды обладают очень слабо выраженными кислотными и основными свойствами. Реагируя со щелочными металлами, они дают соли, легко разлагаемые водой. Некоторые соли тем не менее устойчивы (ртутная соль ацетамида используется при протравке зерна). Амиды способны присоединять протон в присутствии сильной кислоты, образуя соли.
Примечания[ | код]
- ↑ Химическая энциклопедия / Под ред. И. Л. Кнунянца. — М: Большая Российская энциклопедия, 1992. — Т. 5. — С. 33. — ISBN 5-85270-039-8.
- , p. 239—240.
- Dean J. A. Lange’s Handbook of Chemistry. — McGraw-Hill, 1999. — ISBN 0-07-016384-7.
- Sigma-Aldrich. . Дата обращения 2 мая 2013.
- ↑ , p. 244.
- , p. 244—246.
- , p. 247—248.
- , p. 248—249.
- Amarego W. L. F., Chai C. L. L. Purification of Laboratory Chemicals. — Sixth ed. — Elsevier, 2009. — P. 90. — ISBN 978-1-85617-567-8.
- ↑ , p. 240.
- , p. 241—242.
- , p. 243.
- ↑ . Дата обращения 4 мая 2013.
- Speight J. G. Chemical Process and Design Handbook. — McGraw-Hill, 2002. — P. 2.15. — ISBN 0-07-137433-7.
Физические свойства
Бесцветная прозрачная жидкость с фруктовым запахом.
Хорошо смешивается с органическими растворителями. По растворяющей способности аналогичен ацетону и применяется в ряде случаев как его заменитель. Смешивается в любых соотношениях с этанолом и этиловым эфиром, хорошо растворим в ацетоне и хлороформе, растворим в бензоле.
Некоторые свойства отличаются по разным источникам: плотность 0,9330 и 0,9244г/см3; показатель преломления 1,3619 и 1,3593; динамическая вязкость 0,362 и 0,381.
Растворимость в воде 31,9 %, образует с водой азеотропную смесь (температура кипения 56,4 °C, 96,7 % метилацетата). Образует азеотропные смеси с метанолом (температура кипения 54 °C, 81 % метилацетата) и ацетоном (температура кипения 56,1 °C, 45 % метилацетата).
Образует аддукты: метилацетат•SbCl5, метилацетат•HSbCl6 и метилацетат•BF3, плавящиеся, соответственно, при 87-88, 81-82 и 65,5 °С.
Взрывоопасные концентрации в смеси с воздухом 3,15 — 15,60 %.
Реакции
Уксусный ангидрид — универсальный реактив для acetylations, введения групп ацетила к органическим основаниям. В этих преобразованиях уксусный ангидрид рассматривается как источник CHCO. Alcohols и амины с готовностью acetylated. Например, реакция уксусного ангидрида с этанолом приводит к ацетату этила:
: (CHCO) O + CHCHOH → CHCOCHCH + CHCOOH
Часто основа, такая как пиридин добавлена, чтобы функционировать как катализатор. В специализированных заявлениях Льюис кислые скандиевые соли также доказали эффективные катализаторы.
Ароматические кольца — acetylated уксусным ангидридом. Обычно кислотные катализаторы используются, чтобы ускорить реакцию. Иллюстративный преобразования бензола к acetophenone и
ferrocene к acetylferrocene:
: (CH) Fe + (CHCO) O → (CH) Fe (CHCOCH) + CHCOH
Прежний промышленный маршрут к виниловому ацетату включил промежуточное звено ethylidene diacetate. Этот geminal diacetate был получен реакцией ацетальдегида и уксусного ангидрида в присутствии железного катализатора хлорида:
:CHCHO + (CHCO) O → (CHCO) CHCH
Гидролиз
Уксусный ангидрид распадается в воде приблизительно к 2,6% в развес. Водные растворы ограничили стабильность потому что, как большинство кислотных ангидридов, уксусные гидролизы ангидрида, чтобы дать карбоксильные кислоты. В этом случае уксусная кислота сформирована:
: (CHCO) O + HO → 2 CHCOH
Лабораторные методы получения
В лаборатории уксусный ангидрид получают по реакции ацетилхлорида с безводным ацетатом натрия. Также применяют реакцию уксусной кислоты с неорганическими ангидридами и хлорангидридами (SO2Cl2, SOCl2, COCl2, N2O4, POCl3).
Очистка в лабораторных условиях
Уксусный ангидрид достаточной степени очистки обычно можно получить перегонкой с эффективным дефлегматором. Примеси уксусной кислоты удаляют кипячением с карбидом кальция CaC2 или нагреванием с магниевой стружкой (80—90 °С, 5 дней). Осушение уксусного ангидрида проводят над натриевой проволокой в течение недели. Также уксусный ангидрид можно очистить азеотропной перегонкой с толуолом. Быстрый метод очистки заключается во встряхивании уксусного ангидрида с P2O5, затем с карбонатом калия и фракционной перегонке.
Лабораторные методы получения
В лаборатории уксусный ангидрид получают по реакции ацетилхлорида с безводным ацетатом натрия. Также применяют реакцию уксусной кислоты с неорганическими ангидридами и хлорангидридами (SO2Cl2, SOCl2, COCl2, N2O4, POCl3).
Очистка в лабораторных условиях
Уксусный ангидрид достаточной степени очистки обычно можно получить перегонкой с эффективным дефлегматором. Примеси уксусной кислоты удаляют кипячением с карбидом кальция CaC2 или нагреванием с магниевой стружкой (80—90 °С, 5 дней). Осушение уксусного ангидрида проводят над натриевой проволокой в течение недели. Также уксусный ангидрид можно очистить азеотропной перегонкой с толуолом. Быстрый метод очистки заключается во встряхивании уксусного ангидрида с P2O5, затем с карбонатом калия и фракционной перегонке.
Физические и химические свойства
Ацетамид представляет собой игольчатые кристаллы с мышиным запахом, расплывающиеся на влажном воздухе. Хорошо растворим в воде, горячем спирте и ряде органических растворителей, практически нерастворим в бензоле и эфире.
Ацетамид является довольно устойчивым соединением: практически не разлагается при температуре своего кипения при нормальном давлении (221,5 °C), очень медленно разлагается холодными кислотами и щелочами. С горячей щёлочью даёт соответствующий ацетат и аммиак, при кипячении с водным раствором кислоты даёт уксусную кислоту и соответствующую соль аммония. Перегретым водным паром ацетамид разлагается на уксусную кислоту и аммиак.
Ацетамид амфотерен: при взаимодействии с сильными неорганическими кислотами образует нестойкие соли:
-
- CH3CONH2+HCl→CH3CONH3Cl{\displaystyle {\mathsf {CH_{3}CONH_{2}+HCl\rightarrow Cl}}}
способен давать соли с щелочами:
-
- CH3CONH2+KOH→CH3CONHK+H2O{\displaystyle {\mathsf {CH_{3}CONH_{2}+KOH\rightarrow CH_{3}CONHK+H_{2}O}}}
Нагревание ацетамида в токе сухого HCl даёт хлорид аммония и диацетамид (CH3CO)2NH.
При дегидратации ацетамид образует ацетонитрил, в реакции с гипохлоритами щелочных металлов образует метиламин.
Применение — уксусный ангидрид
Применение уксусного ангидрида в количестве свыше 1 Г моля обычно не дает заметного улучшения, так как при 2 молях уксусного ангидрида выход увеличивается только на 1 — 3 % апри еще большем избытки выход релко снижается. Применение илдиференгного растворителя, как толуол или нитробензол, вызывает заметное снижение выхода и даже может совсем приостановить реакцию.
Применение уксусного ангидрида в качестве дифференцирующего растворителя, рекомендованное в настоящей работе, представляет более общий аналитический интерес и заслуживает широкого распространения наряду с предложенными ранее растворителями.
Применение уксусного ангидрида является полезным видоизменением в тех случаях, когда с ледяной уксусной кислотой образуются главным образом симметричные алкильные производные мочевины.
Недостатком применения уксусного ангидрида является то, что определению гидроксильных групп мешают альдегиды.
При применении уксусного ангидрида в качестве воюотнимающсго вещества улучшаются условия конденсации формальдегида с аммонийной селитрой.
|
Баланс по десорбции оснований нефти и характеристика полученных концентратов. |
При применении уксусного ангидрида не следует забывать о возможности ацилирования гидроксильных и амино-групп в исследуемых системах.
В методах с применением уксусного ангидрида присутствие сильных кислот ( в качестве катализаторов) обусловливает большее число побочных реакций по сравнению с некатализируемым гидролизом.
|
Установка для непрерывного сульфохлорирования в облучаемом лампами реакторе при длительной циркуляции реакционной массы. |
Процесс сульфоокисления с применением уксусного ангидрида осуществляется в колонне, предварительно заполненной исходным, тщательно высушенным парафиновым сырьем и уксусным ангидридом.
Установлено, что в случае применения уксусного ангидрида реакция приводит к образованию окиси метилендиарсина.
Когда разработка этого метода была закончена, Нодзаки сообщил, что применение уксусного ангидрида вместо уксусной кислоты позволяет устранить недостатки, связанные с ее применением как растворителя. Было установлено, что эффективность иодометрического определения повышается в результате замены иодида калия иодидом натрия, который значительно более растворим в реакционной смеси, чем достигаются более высокая концентрация иодид-иона, повышение скорости реакции и понижение степени присоединения иода к ненасыщенным соединениям. Точность анализа повышается также при удалении из реакционной смеси воды, которая способствует автоокислению олефинов. Липе, Чап-мен и Мак Фарлейн отмечают, что вода заметно снижает результаты иодометрического определения жиров, а Либхафский и Шарки наблюдали, что вода замедляет восстановление пероксидов иодид-ионом
Чтобы избежать возможного влияния кислорода воздуха, реакцию проводили в атмосфере диоксида углерода, а пробу и реакционную смесь перед анализом деаэрировали, однако такие предосторожности при обычной работе не обязательны.
Ангидрид ее может быть получен из кислоты непосредственной перегонкой в вакууме; однако при применении уксусного ангидрида получается более чистый препарат.
В случае применения хлористого ацетила получается лучший выход и меньшее количество высококипящего остатка, чем в случае применения уксусного ангидрида.
При нитровании анилина в присутствии слабой кислоты, а именно, ледяной уксусной кислоты, и при применении уксусного ангидрида в качестве водоотнимающего средства образуется 75 % о-нитроанилина и 25 % р-нитроанилина.