Оксид хрома: формула, характеристика и химические свойства
Содержание:
Окись хрома, Оксид хрома (III) ГОСТ 2912-79
Окись хрома
В зависимости от области применения окись хрома техническая выпускается следующих марок и сортов:
Пигментная — сортов ОХП-1 и ОХП-2;
Металлургическая — сортов ОХМ-0 и ОХМ-1;
Абразивная — сортов ОХА-0, ОХА-1 и ОХА-2.
Химическая формула: Cr2O3
Области применения:
Пигментная — в лакокрасочной промышленности для изготовления грунтовок, красок и эмалей (в том числе термостойких), а также для изготовления художественных и типографских красок разных типов, окраски пластмасс, стеклянных эмалей и т. д. В производстве строительных материалов в качестве пигмента;
Металлургическая — в металлургической промышленности для производства металлического хрома, абразивных материалов и в производстве огнеупоров;
Абразивная — в часовой, приборостроительной, машиностроительной и других отраслях промышленности для полировальных процессов.
Физико-химические показатели окиси хрома технической марки «пигментная» ГОСТ 2912-79:
| Наименование показателя | Норма для сорта | |
| ОХП-1 | ОХП-2 | |
| Внешний вид | Порошок зеленого цвета | |
| Массовая доля общего хрома в пересчете на Cr2O3, %, не менее | 99 | 99 |
| Массовая доля влаги, %, не более | 0.15 | 0.15 |
| Массовая доля веществ, растворимых в воде, %, не более | 0.1 | 0.2 |
| рН водного раствора | 6-8 | 6-8 |
| Относительная красящая способность, %, не менее | 105 | 95 |
| Укрывистость, г/м², не более | 12 | 14 |
| Остаток на сите № 0063К, %, не более | 0.1 | 0.2 |
Требования безопасности окиси хрома технической марки «пигментная» ГОСТ 2912-79:
| Класс опасности | 2 |
| Основные свойства и виды опасности | |
| Основные свойства | Порошок зеленого цвета, не растворим в воде, этиловом спирте, ацетоне. Труднорастворим в кислотах и щелочах, за исключением горячей 70% хлорной кислоты, окисляющей ее в хромовый ангидрид. Цвет при нагревании переходит в коричневый. Твердость корунда. Обладает мажущими свойствами. Температура плавления 2275° С. |
| Взрыво- и пожароопасность | Пожаро- и взрывобезопасна. Окислителем не является. Опасности при сгорании не вызывает. |
| Опасность для человека | Окись хрома поступает в организм при вдыхании в виде аэрозоля и может вызвать острые отравления. При длительном воздействии соединения трехвалентного хрома оказывают общетоксическое действие, вызывая заболевания органов дыхания, желудочно-кишечного тракта и почек. При поражении кожных покровов вызывает дерматиты, экземы, при попадании на поврежденную кожу — появление язв. |
| Средства индивидуальной защиты | Респиратор типа «Лепесток-200» и У-2К, герметичные защитные очки, рукавицы. Необходимо соблюдать правила личной гигиены, после окончания работы обязательно принять душ. |
| Необходимые действия в аварийных ситуациях | |
| Общего характера | Удалить посторонних из опасной зоны. Держаться с наветренной стороны. В опасную зону входить в защитных средствах и дыхательном аппарате. Изолировать опасную зону. Пострадавшим оказать первую помощь. |
| При утечке, разливе и россыпи | Не допускать россыпи и попадания в канализацию, открытые водоемы, грунтовые воды, почву. При рассыпании собрать в герметичные емкости и вывезти вместе с поврежденными упаковками на утилизацию на специальные полигоны. В случае заражения воды сообщить в СЭС. Место россыпи промыть большим количеством воды. |
| Меры первой помощи | При попадании на кожу — обильно промыть водой в течение 15 минут, наложить повязку с нейтральной мазью, обратиться к врачу. При попадании в глаза — обильно промыть водой в течение 15 минут, закапать 30%-ным раствором альбуцида, при резких болях 0,5%-ным раствором дикаина. При попадании в органы пищеварения — вызвать врача, промыть желудок теплой водой с содой, танином, активированным углем. Принимать во внутрь молоко, яичный белок, слизистые отвары, жженую магнезию. При ингаляционном отравлении — свежий воздух, покой, лечение симптоматическое. При вдыхании — промыть слизистые оболочки носа водой с мылом, смазать носовые ходы вазелиновой мазью. |
Окись хрома техническую упаковывают в мягкие специализированные контейнеры разового использования; стальные барабаны для химической продукции; полиэтиленовые мешки-вкладыши, вложенные в бумажные мешки массой нетто 30-50 кг.
Окись хрома техническую транспортируют всеми видами транспорта (кроме воздушного) в крытых транспортных средствах. По железной дороге упакованную продукцию транспортируют повагонными отправками. Мягкие контейнеры транспортируют открытым подвижным составом.
Окись хрома техническую хранят в закрытых складских помещениях в неповрежденной упаковке. Мягкие контейнеры хранят на контейнерных площадках.
Примечания
- Редкол.:Зефиров Н. С. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1999. — Т. 5. — С. 308.
-
1. Дроздов А. А. и др. Неорганическая химия: В 3 т./Под ред. ЮД Третьякова. T. 2: Химия переходных металлов. – 2004.
2. Greenwood N. N., Earnshaw A. Chemistry of the Elements. – 1984.
- . Энциклопедия «Кругосвет».
- ↑
- Поваренных А. С. Твердость минералов. — АН УССР, 1963. — С. 197—208. — 304 с.
- Реми Г. Курс неорганической химии. Т. 2. М., Мир, 1966. С. 142—180.
- Некрасов Б. В. Курс общей химии. М:, ГНХТИ, 1952, С. 334
- Gerd Anger, Jost Halstenberg, Klaus Hochgeschwender, Christoph Scherhag, Ulrich Korallus, Herbert Knopf, Peter Schmidt, Manfred Ohlinger, «Chromium Compounds» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.
- ↑
Химические свойства хрома
- при t=300°C реагирует с кислородом: 4Cr + 3O2 = 2Cr2O3;
- при t>300°C реагирует с галогенами, образуя смеси галогенидов;
- при t>400°C реагирует с серой, с образованием сульфидов: Cr + S = CrS;
- при t=1000°C тонкоизмельченный хром реагирует с азотом, образуя нитрид хрома (полупроводник, обладающий высокой химической устойчивостью): 2Cr + N2 = 2CrN;
- реагирует с разбавленными соляной и серной кислотами с выделением водорода:
Cr + 2HCl = CrCl2 + H2; Cr + H2SO4 = CrSO4 + H2; - теплые концентрированные азотная и серная кислоты растворяют хром.
С концентрированными серной и азотной кислотой при н.у. хром не взаимодействует, также не растворяется хром и в царской водке, примечательно, что чистый хром не вступает в реакцию даже с разбавленной серной кислотой, причина этого феномена до сих пор не установлена. При длительном хранении в концентрированной азотной кислоте хром покрывается очень плотной оксидной пленкой (пассивируется), и перестает реагировать с разбавленными кислотами.
Хром в сплавах
Вероятно, было бы противоестественным, если бы рассказ о применении хрома и его соединений начался не со стали, а с чего-либо иного. Хром — один из самых важных легирующих элементов, применяемых в черной металлургии. Добавка хрома к обычным сталям (до 5% Сг) улучшает их физические свойства и делает металл более восприимчивым к термической обработке. Хромом легируют пружинные, рессорные, инструментальные, штамповые и шарикоподшипниковые стали. В них (кроме шарикоподшипниковых сталей) хром присутствует вместе с марганцем, молибденом, никелем, ванадием. А шарикоподшипниковые стали содержат лишь хром (около 1,5%) и углерод (около 1 %). Последний образует с хромом карбиды исключительной твердости: Сг3С, Сг7С3 и Сг23С6. Они придают шарикоподшипниковой стали высокую износостойкость.
Если содержание хрома в стали повысить до 10% и более, сталь становится более стойкой к окислению и коррозии, но здесь вступает в силу фактор, который можно назвать углеродным ограничением. Способность углерода связывать большие количества хрома приводит к обеднению стали этим элементом. Поэтому металлурги оказываются перед дилеммой: хочешь получить коррозионную стойкость — уменьшай содержание углерода и теряй на износостойкости и твердости.
Нержавеющая сталь самой распространенной марки содержит 18% хрома и 8% никеля. Содержание углерода в ней очень невелико —до 0,1%. Нержавеющие стали хорошо противостоят коррозии и окислению, сохраняют прочность при высоких температурах. Из листов такой стали сделана скульптурная группа В. И. Мухиной «Рабочий и колхозница», которая установлена в Москве у Северного входа на Выставку достижений народного хозяйства. Нержавеющие стали широко используются в химической и нефтяной промышленности.
Высокохромистые стали (содержащие 25—30% Сr) обладают особой стойкостью к окислению при высокой температуре. Их применяют для изготовления деталей нагревательных печей.
Теперь несколько слов о сплавах на основе хрома. Это сплавы, содержащие более 50% хрома. Они обладают весьма высокой жаропрочностью. Однако у них есть очень большой недостаток, сводящий на нет все преимущества: эти сплавы очень чувствительны к поверхностным дефектам: достаточно появиться царапине, микротрещине, и изделие быстро разрушится под нагрузкой. У большинства сплавов подобные недостатки устраняются термомеханической обработкой, но сплавы на основе хрома такой обработке не поддаются. Кроме того, они чересчур хрупки при комнатной температуре, что также ограничивает возможности их применения.
Более ценны сплавы хрома с никелем (в них часто вводятся как легирующие добавки и другие элементы). Самые распространенные сплавы этой группы — нихромы содержат до 20% хрома (остальное никель) и применяются для изготовления нагревательных элементов. У нихромов — большое для металлов электросопротивление, при пропускании тока они сильно нагреваются.
Добавка к хромоникелевым сплавам молибдена и кобальта позволяет получить материалы, обладающие высокой жаропрочностью, способностью выносить большие нагрузки при 650—900° С. Из этих сплавов делают, например, лопатки газовых турбин. Жаропрочностью обладают также хромокобальтовые сплавы, содержащие 25-30% хрома. Промышленность использует хром и как материал для антикоррозионных и декоративных покрытий.
Вы читаете, статья на тему хром свойства и сплавы
Метаболизм и выведение
Большая часть поглощенных хроматных анионов абсорбируется в эритроцитах.
Cr (VI), остающийся в плазме крови, частично переносится в клетки печени и почек. Небольшие количества были также обнаружены в селезенке и костном мозге.
В организме Cr (VI) восстанавливается до Cr (III). Есть указания на то, что патогенный эффект напрямую связан именно с этой трансформацией.
После вдыхания хром почти исключительно выводится через почки. По аналогии с воздействием хромата наблюдалось двухфазное течение. После первоначальной быстрой элиминации (период полувыведения 1-2 дня) следовала медленная фаза (период полураспада около 1 месяца).
Способы получения
Разложение дихромата аммония (начинается при 168—185 °С):
-
- (NH4)2Cr2O7→168−185°СCr2O3+N2+4H2O{\displaystyle {\ce {(NH_4)_2Cr_2O_7 -> Cr_2O_3 + N_2 + 4H_2O}}}
При разложении дихромата аммония ощущается слабый запах аммиака (так как одна из параллельных реакций идет с образованием аммиака) и получается оксид хрома (III) с содержанием по основному продукту 95-97 %, нестехиометрического кислорода содержится 3 — 5 %. Прокалкой при 1000 °С в течение 3-4 часов получен оксид хрома (III) с содержанием по основному продукту до 99,5 %.
Реакция разложения бихромата аммония на воздухе протекает спокойно (Шидловский А.А., Оранжереев С.А. Исследование процесса горения неорганических солей бихромата и трихромата аммония. Статья// Журнал Прикладной Химии (ЖПХ), 1953, т. XXVI, №1. — 5 с.)
В случае проведения реакции разложения в герметичной аппаратуре возможен взрыв. Попытка высушить бихромат аммония в герметичном реакторе привела к взрыву и многочисленным человеческим жертвам: в январе 1986 года двое рабочих погибли и 14 пострадали в США при взрыве 900 килограмм бихромата аммония во время сушки. (Diamond, S. The New York Times, 1986, p. 22. ).
Разложение дихромата калия (при 500—600 °С):
-
- 4K2Cr2O7→2Cr2O3+4K2CrO4+3O2{\displaystyle {\mathsf {4K_{2}Cr_{2}O_{7}\rightarrow 2Cr_{2}O_{3}+4K_{2}CrO_{4}+3O_{2}}}}
Разложение гидроксида хрома(III) (при 430—1000 °С):
-
- 2Cr(OH)3→Cr2O3+3H2O{\displaystyle {\mathsf {2Cr(OH)_{3}\rightarrow Cr_{2}O_{3}+3H_{2}O}}}
Разложение оксида хрома (VI):
-
- 4CrO3→2Cr2O3+3O2{\displaystyle {\mathsf {4CrO_{3}\rightarrow 2Cr_{2}O_{3}+3O_{2}}}}
Восстановление дихромата калия:
-
- K2Cr2O7+S→K2SO4+Cr2O3{\displaystyle {\mathsf {K_{2}Cr_{2}O_{7}+S\rightarrow K_{2}SO_{4}+Cr_{2}O_{3}}}}
Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В чистом виде хром довольно токсичен, металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты.
Пример соединения хрома (VI): Оксид хрома (VI)
Соединения хрома в степени окисления +6 особо токсичны. Практически вся хромовая руда обрабатывается через преобразование в дихромат натрия. В 1985 году было произведено примерно 136 000 тонн шестивалентного хрома. Другими источниками шестивалентного хрома являются триоксид хрома и различные соли — хроматы и дихроматы. Шестивалентный хром используется при производстве нержавеющих сталей, текстильных красок, консервантов для дерева, при хромировании и пр.
Шестивалентный хром является признанным канцерогеном при вдыхании. На многих рабочих местах сотрудники подвержены воздействию шестивалентного хрома, например, при гальваническом хромировании или сварке нержавеющих сталей. В Европейском союзе использование шестивалентного хрома существенно ограничено директивой RoHS.
Шестивалентный хром транспортируется в клетки человеческого организма с помощью сульфатного транспортного механизма благодаря своей близости к сульфатам по структуре и заряду. Трёхвалентный хром, более часто встречающийся, не транспортируется в клетки.
Внутри клетки Cr(VI) восстанавливается до метастабильного пятивалентного хрома (Cr(V)), затем до трёхвалентного хрома (Cr(III)). Трёхвалентный хром, присоединяясь к протеинам, создаёт гаптены, которые включают иммунную реакцию. После их появления чувствительность к хрому не пропадает. В этом случае даже контакт с текстильными изделиями, окрашенными хромсодержащими красками или с кожей, обработанной хромом, может вызвать раздражение кожи. Витамин C и другие агенты реагируют с хроматами и образуют Cr(III) внутри клетки.
Продукты шестивалентного хрома являются генотоксичными канцерогенами. Хроническое вдыхание соединений шестивалентного хрома увеличивает риск заболеваний носоглотки, риск рака лёгких. (Лёгкие особенно уязвимы из-за большого количества мелких капилляров). Видимо, механизм генотоксичности запускается пяти- и трёхвалентным хромом.
В США предельно допустимая концентрация шестивалентного хрома в воздухе составляет 5 мкг/м³ (0,005 мг/м³).
В России предельно допустимая концентрация хрома (VI) существенно ниже — 1,5 мкг/м³ (0,0015 мг/м³).
Одним из общепризнанных методов избежания шестивалентного хрома является переход от технологий гальванического хромирования к газотермическому и вакуумному напылению.
Основанный на реальных событиях фильм «Эрин Брокович» режиссёра Стивена Содерберга рассказывает о крупном судебном процессе, связанном с загрязнением окружающей среды шестивалентным хромом, в результате которого у многих людей развились серьёзные заболевания.
Оксид хрома CrO2(IV) (диоксид хрома)
Диоксид хрома применяется в производстве элементов памяти для компьютеров.
- все диоксиды элементов 6-й группы (Cr, Mo, W) имеют структуру рутила;
- не реагируют с водой и щелочами;
- диоксид хрома имеет черную окраску, обладает металлической проводимостью, является ферромагнетиком;
- диоксиды, как промежуточный прдукт реакции, получают при разложении или восстановлении высших оксидов (VI) соответствующих металлов, при темературах 250°(Cr), 450°C(Mo), 600°C(W):
3(NH4)Cr2O7 → 6CrO2+2N2+9H2O+2NH3
MoO3+H2 → MoO2+H2O
WO3+H2 → WO2+H2O - диоксид хрома получают нагреванием Cr2O3 в кислороде при 300°C и высоком давлении;
- устойчивость диоксида возрастает в ряду от хрома к вольфраму.
Свойства
Физические свойства
Чёрно-красные с фиолетовым оттенком кристаллы — пластины или иголки. Гигроскопичен, расплывается на воздухе.
tпл=196 °C, при атмосферном давлении разлагается ниже температуры кипения.
Плотность 2,8 г/см³; Растворимость в воде — 166 г/100 г (15 °C), 199 г/100 г (100 °C).
Химические свойства
CrO3 — кислотный оксид. При его растворении в воде образуется хромовая кислота (при недостатке CrO3):
-
- CrO3+H2O→H2CrO4{\displaystyle {\mathsf {CrO_{3}+H_{2}O\rightarrow H_{2}CrO_{4}}}}
или дихромовая кислота (при избытке CrO3):
-
- 2CrO3+H2O→H2Cr2O7{\displaystyle {\mathsf {2CrO_{3}+H_{2}O\rightarrow H_{2}Cr_{2}O_{7}}}}
При взаимодействии CrO3 со щелочами образуются хроматы:
-
- CrO3+2KOH→K2CrO4+H2O{\displaystyle {\mathsf {CrO_{3}+2KOH\rightarrow K_{2}CrO_{4}+H_{2}O}}}
При нагревании выше 250 °C разлагается с образованием оксида хрома(III) и кислорода:
-
- 4CrO3→2Cr2O3+3O2{\displaystyle {\mathsf {4CrO_{3}\rightarrow 2Cr_{2}O_{3}+3O_{2}}}}
Как и все соединения Cr(VI), CrO3 является сильным окислителем (восстанавливается до Cr2O3). Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с предварительно измельченным до состояния порошка оксидом хрома VI (хотя некоторые справочники указывают «растворим в спирте и эфире»). Без тщательного измельчения кристаллов хромового ангидрида добиться воспламенения спиртов и кетонов при контакте с ним невозможно. Окисляет иод, серу, фосфор, уголь, например:
-
- 4CrO3+3S→2Cr2O3+3SO2{\displaystyle {\mathsf {4CrO_{3}+3S\rightarrow 2Cr_{2}O_{3}+3SO_{2}}}}
Комплекс триоксида хрома с пиридином используется для окисления спиртов в соответствующие карбонильные соединения (реакция Саретта).
Токсичность
Оксид хрома(VI) очень ядовит и канцерогенен, как и многие другие соединения шестивалентного хрома. Летальная доза для человека при попадании внутрь 0,08 г/кг.
Техника безопасности
Хромовый ангидрид — весьма химически активное вещество, способен вызвать при соприкосновении с органическими веществами возгорания и взрывы. Сам негорюч, но воспламеняет бензин при комнатной температуре и используется в качестве воспламенителя топлива в ракетной технике. При попадании на кожу вызывает сильные раздражения, экземы и дерматиты, а также может спровоцировать развитие рака кожи. Даже при своевременном удалении с кожных покровов оставляет пятна коричневого цвета. Весьма опасно вдыхание паров хромового ангидрида, хотя он и малолетуч.
Для хранения его применяется стеклянная или фарфоровая герметичная посуда, необходимо исключение контакта с органическими веществами. Работа с ним требует применения спецодежды и средств индивидуальной защиты.
Получение
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
-
- Fe(CrO2)2+4C→Fe+2Cr+4CO{\displaystyle {\mathsf {Fe(CrO_{2})_{2}+4C\rightarrow Fe+2Cr+4CO}}}
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
-
- 4Fe(CrO2)2+8Na2CO3+7O2→8Na2CrO4+2Fe2O3+8CO2{\displaystyle {\mathsf {4Fe(CrO_{2})_{2}+8Na_{2}CO_{3}+7O_{2}\rightarrow 8Na_{2}CrO_{4}+2Fe_{2}O_{3}+8CO_{2}}}}
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём:
-
- Na2Cr2O7+2C→Cr2O3+Na2CO3+CO{\displaystyle {\mathsf {Na_{2}Cr_{2}O_{7}+2C\rightarrow Cr_{2}O_{3}+Na_{2}CO_{3}+CO}}}
5) с помощью алюминотермии получают металлический хром:
-
- Cr2O3+2Al→Al2O3+2Cr+130kcal{\displaystyle {\mathsf {Cr_{2}O_{3}+2Al\rightarrow Al_{2}O_{3}+2Cr+130kcal}}}
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
- восстановление шестивалентного хрома до трёхвалентного с переходом его в раствор;
- разряд ионов водорода с выделением газообразного водорода;
- разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
-
- Cr2O72−+14H++12e−→2Cr+7H2O{\displaystyle {\mathsf {Cr_{2}O_{7}^{2-}+14H^{+}+12e^{-}\rightarrow 2Cr+7H_{2}O}}}
История
История
Открыт на Среднем Урале, в Березовском золоторудном месторождении. Впервые упоминается в труде М. В. Ломоносова «Первые основания металлургии» (1763 год), как красная свинцовая руда, PbCrO4. Современное название — крокоит. В 1797 году французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (Воклен получил карбид хрома). Он прокалил зелёный оксид Cr2O3 с углём и выделил тугоплавкий металл (с примесью карбидов). Сам оксид Cr2O3 Воклен получил разложением «Сибирского красного свинца» — минерала крокоита PbCrO4.
Современный способ получения чистого хрома (с 1894 г.) отличается от способа Воклена только видом восстановителя. Процесс электролитического покрытия железа хромом разработан в 20-х годах ХХ в.
Получение и применение
За счет высокой твердости (сопоставимой с корундом) наиболее распространено использование вещества в абразивных и полирующих материалах. Оксид хрома (формула Cr2O3) имеет зеленый цвет, поэтому его применяют в качестве пигмента при изготовлении стекол, красок, керамики. Для химической промышленности данное вещество используется как катализатор для протекания реакций с органическими соединениями (синтез аммиака). Трехвалентный оксид хрома применяется для создания искусственных драгоценных камней и шпинелей. Для получения используется несколько видов химических реакций:
- Окисление закиси хрома.
- Нагревание (прокаливанием) бихромата или хромата аммония.
- Разложение гидроксида трехвалентного хрома или шестивалентного оксида.
- Прокаливание хромата или бихромата ртути.
Геохимия и минералогия
Среднее содержание хрома в различных изверженных породах резко непостоянно. В ультраосновных породах (перидотитах) оно достигает 2 кг/т, в основных породах (базальтах и др.) — 200 г/т, а в гранитах десятки г/т. Кларк хрома в земной коре 83 г/т. Он является типичным литофильным элементом и почти весь заключён в минералах типа хромшпинелидов. Хром вместе с железом, титаном, никелем, ванадием и марганцем составляют одно геохимическое семейство.
Различают три основных минерала хрома: магнохромит (Mg, Fe)Cr2O4, хромпикотит (Mg, Fe)(Cr, Al)2O4 и алюмохромит (Fe, Mg)(Cr, Al)2O4. По внешнему виду они неразличимы, и их неточно называют «хромиты». Состав их изменчив:
- Cr2O3 18—62 %,
- FeO 1—18 %,
- MgO 5—16 %,
- Al2O3 0,2 — 0,4 (до 33 %),
- Fe2O3 2 — 30 %,
- примеси TiO2 до 2 %,
- V2O5 до 0,2 %,
- ZnO до 5 %,
- MnO до 1 %; присутствуют также Co, Ni и др.
Собственно, хромит, то есть FeCr2O4 сравнительно редок. Помимо различных хромитов, хром входит в состав ряда других минералов — хромовой слюды (фуксита), хромового хлорита, хромвезувиана, хромдиопсида, хромтурмалина, хромового граната (уваровита) и др., которые нередко сопровождают руды, но сами промышленного значения не имеют. В экзогенных условиях хром, как и железо, мигрирует в виде взвесей и может накапливаться в глинах. Наиболее подвижной формой являются хроматы.
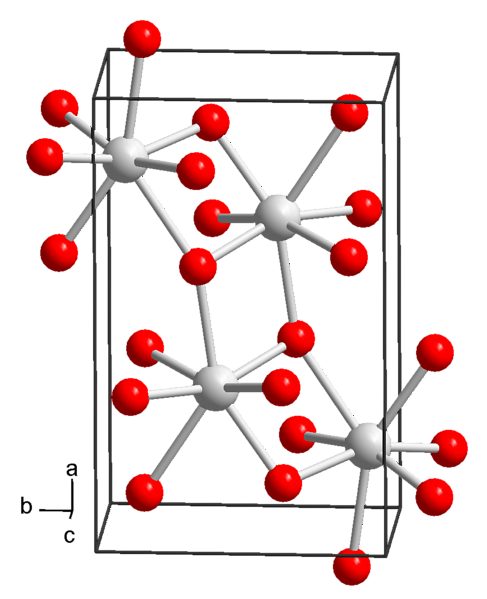
Оксид хрома Cr2O3(III) — хромовая охра
Cr2O3 в мелкоизмельченном состоянии применяют в качестве абразивного материала (паста ГОИ), зеленого пигмента, катализатора в органическом синтезе. Оксид хрома (III) является основной добавкой к корунду при выращивании искусственных рубинов, используемых в ювелирной промышленности и часовом деле, а также в качестве лазерного материала в оптоэлектронике.
Физические свойства Cr2O3(III):
- тугоплавкий порошок серо-зеленого цвета, имеющий структуру корунда (α-Al2O3);
- нерастворим в воде;
- обладает высокой твердостью;
- меняет свой цвет от светло-зеленого до черного в зависимости от размеров кристаллов;
- при н.у. является полупроводником;
- при нагревании порошок приобретает коричневый цвет, при охлаждении зеленая окраска возвращается;
- Cr2O3 с корундом образует твердые растворы, в которых катионы хрома и алюминия заполняют пустоты анионной решетки, такие твердые растворы с содержанием Cr2O3 до 10% имеют красный цвет, и в природе известны под названием рубин, который является драгоценным камнем-минералом. Твердые растворы в которых содержание оксида хрома превышает 10%, имеют зеленый цвет (окраска твердого раствора зависит от расстояния связи металл-кислород).
Химические свойства Cr2O3(III):
- Cr2O3 амфотерный оксид — самое устойчивое соединение хрома;
- при н.у. плохо растворим в кислотах и щелочах;
- при сплавлении с щелочами (карбонатами щелочных металлов) образует метахромиты:
Cr2O3+2KOH = 2KCrO2+H2O
Cr2O3+Na2CO3 = 2NaCrO2+CO2↑ - с кислотами образует соли:
Cr2O3+6HCl = 2CrCl3+3H2O - с щелочами образует комплексные соединения хрома:
Cr2O3+6KOH+3H2O = 2K2[Cr(OH)6] - в промышленности Cr2O3 получают восстановлением дихромата калия серой или коксом:
K2Cr2O7+S = Cr2O3+K2SO4 - Cr2O3 также можно получить разложением дихромата аммония или прокаливанием гидроксида хрома:
(NH4)Cr2O7 = Cr2O3+N2+4H2O
2Cr(OH)3 = Cr2O3+3H2O
Как получают и где применяют
Оксид хрома 6 получают обработкой хроматов (бихроматов) натрия или калия концентрированной серной кислотой либо при реакции хромата серебра с хлороводородной кислотой. Высокая химическая активность вещества обуславливает основные направления его применения:
- Получение чистого металла — хрома.
- В процессе хромирования поверхностей, в том числе электролитическим способом.
- Окисление спиртов (органических соединений) в химической промышленности.
- В ракетной технике используется в качестве воспламенителя топлива.
- В химических лабораториях очищает посуду от органических соединений.
- Используется в пиротехнической отрасли.
Химические свойства
Относится к группе амфотерных оксидов. В высокодисперсном состоянии растворяется в сильных кислотах с образованием солей хрома(III):
-
- Cr2O3+6HCl→2CrCl3+3H2O{\displaystyle {\mathsf {Cr_{2}O_{3}+6HCl\rightarrow 2CrCl_{3}+3H_{2}O}}}
В сильнокислой среде может идти реакция:
-
- Cr2O3+6H++9H2O→2Cr(H2O)63+{\displaystyle {\mathsf {Cr_{2}O_{3}+6H^{+}+9H_{2}O\rightarrow 2^{3+}}}}
При сплавлении со щелочами и содой даёт растворимые соли Cr3+ (в отсутствие окислителей):
-
- Cr2O3+2KOH→2KCrO2+H2O{\displaystyle {\mathsf {Cr_{2}O_{3}+2KOH\rightarrow 2KCrO_{2}+H_{2}O}}}
-
- Cr2O3+Na2CO3→2NaCrO2+CO2{\displaystyle {\mathsf {Cr_{2}O_{3}+Na_{2}CO_{3}\rightarrow 2NaCrO_{2}+CO_{2}}}}
Поскольку Cr2O3 — соединение хрома в промежуточной степени окисления, в присутствии сильного окислителя в щелочной среде он окисляется до хромата:
-
- Cr2O3+3KNO3+2Na2CO3→2Na2CrO4+3KNO2+2CO2{\displaystyle {\mathsf {Cr_{2}O_{3}+3KNO_{3}+2Na_{2}CO_{3}\rightarrow 2Na_{2}CrO_{4}+3KNO_{2}+2CO_{2}}}}
а сильные восстановители его восстанавливают:
-
- Cr2O3+2Al→Al2O3+2Cr{\displaystyle {\mathsf {Cr_{2}O_{3}+2Al\rightarrow Al_{2}O_{3}+2Cr}}}
Гидроксид хрома Cr(OH)3(III)
Физические свойства Cr(OH)3(III):
- амфотерный малоустойчивый гидроксид различной окраски (голубой, фиолетовой, зеленой), которая зависит от условий получения;
- имеет различную химическую активность;
- плохо растворим в воде.
Химические свойства Cr(OH)3(III):
- реагирует с кислотами с образованием солей:Cr(OH)3+3H2SO4 = Cr2(SO4)3+6H2O
- реагирует с щелочами с образованием комплексных соединений хрома:Cr(OH)3+NaOH = Na[Cr(OH)4]
- осаждается при действии щелочей на соли хрома:Cr(OH)3+3NaOH = Cr(OH)3↓+3NaCl
- выпавший в осадок гидрооксид хрома растворим в кислотах:Cr(OH)3+3HCl = CrCl3+3H2O
- и в избытке щелочей:Cr(OH)3+3NaOH = Na3[Cr(OH)6]
Хром
В 18 веке химик И. Г. Леман обнаружил неизвестный минерал, который был назван красным сибирским свинцом. Профессор Парижской минералогической школы Вокелен провел ряд химических реакций с полученным образцом, в результате которых был выделен неизвестный металл. Основными свойствами, обозначенными ученым, стали его устойчивость к кислотным средам и тугоплавкость (жаропрочность). Название «хром» (Chromium) возникло из-за широкой цветовой гаммы, которая характеризуется соединениям элемента. Металл достаточно инертен, в чистом виде не встречается в природных условиях.
Основными минералами, содержащими хром, являются: хромит (FeCr2O4), меланохроит, вокеленит, дитцеит, тарапакаит. Химический элемент Cr располагается в 6 группе периодической системы Д. И. Менделеева, имеет атомный номер 24. Электронная конфигурация атома хрома позволяет элементу иметь валентность +2, +3, +6, при этом наиболее устойчивыми являются соединения трехвалентного металла. Возможны реакции, при которых степень окисления равна +1, +5, +4. Хром химически не активен, поверхность металла покрывается пленкой (эффект пассивирования), предотвращающей реакции с кислородом и водой при нормальных условиях. Оксид хрома, образующийся на поверхности, предохраняет металл от взаимодействия с кислотами и галогенами при отсутствии катализаторов. Соединения с простыми веществами (не металлами) возможны при температуре от 300 оС (хлор, бром, сера).
При взаимодействии со сложными веществами требуются дополнительные условия, например, с раствором щелочи реакция не происходит, с ее расплавами процесс происходит очень медленно. С кислотами хром вступает в реакцию при наличии в качестве катализатора высокой температуры. Оксид хрома можно получить из различных минералов путем воздействия температуры. В зависимости от будущей степени окисления элемента применяются концентрированные кислоты. При этом валентность хрома в соединении варьируется от +2 до +6 (высший оксид хрома).