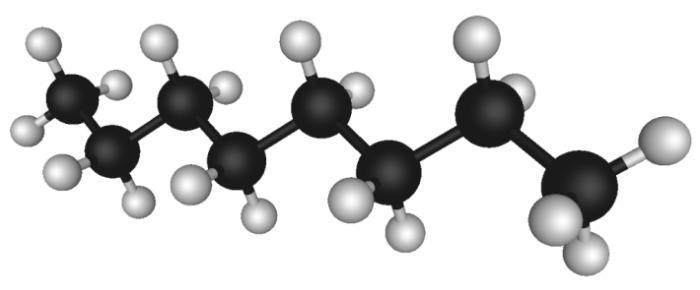
Сложные эфиры
Содержание:
Применение и свойства[править]
Сложные эфиры широко используются в качестве растворителей, пластификаторов, ароматизаторов.
Эфиры муравьиной кислоты:
- HCOOCH3 — метилформиат, tкип = 32 °C; растворитель жиров, минеральных и растительных масел, целлюлозы, жирных кислот; ацилирующий агент; используют в производстве некоторых уретанов, формамида.
- HCOOC2H5 — этилформиат, tкип = 53 °C; растворитель нитрата и ацетата целлюлозы; ацилирующий агент; отдушка для мыла, его добавляют к некоторым сортам рома, чтобы придать ему характерный аромат; применяют в производстве витаминов B1, A, E.
- HCOOCH2CH(CH3)2 — изобутилформиат несколько напоминает запах ягод малины.
- HCOOCH2CH2CH(CH3)2 — изоамилформиат (изопентилформиат) растворитель смол и нитроцеллюлозы.
- HCOOC6H5 — бензилформиат, tкип = 202 °C; имеет запах жасмина; используется как растворитель лаков и красителей.
- HCOOCH2CH2C6H5 — 2-фенилэтилформиат имеет запах хризантем.
Эфиры уксусной кислоты:
- CH3COOCH3 — метилацетат, tкип = 58 °C; по растворяющей способности аналогичен ацетону и применяется в ряде случаев как его заменитель, однако он обладает большей токсичностью, чем ацетон.
- CH3COOC2H5 — этилацетат, tкип = 78 °C; подобно ацетону растворяет большинство полимеров. По сравнению с ацетоном его преимущество в более высокой температуре кипения (меньшей летучести).
- CH3COOC3H7 — н-пропилацетат, tкип = 102 °C; по растворяющей способности подобен этилацетату.
- CH3COOCH(CH3)2 — изопропилацетат, tкип = 88 °C; по растворяющим свойствам занимает промежуточное положение между этил- и пропилацетатом.
- CH3COOC5H11 — н-амилацетат (н-пентилацетат), tкип = 148 °C; напоминает по запаху грушу, применяется как растворитель для лаков, поскольку он испаряется медленнее, чем этилацетат.
- CH3COOCH2CH2CH(CH3)2 — изоамилацетат (изопентилацетат) напоминает по запаху бананы.
- CH3COOC8H17 — н-октилацетат имеет запах апельсинов.
Эфиры масляной кислоты:
- C3H7COOCH3 — метилбутират, tкип = 102,5 °C; по запаху напоминает ранет.
- C3H7COOC2H5 — этилбутират, tкип = 121,5 °C; имеет характерный запах ананасов.
- C3H7COOC4H9 — бутилбутират, tкип = 166,4 °C;
- C3H7COOC5H11 — н-амилбутират (н-пентилбутират) и C3H7COOCH2CH2CH(CH3)2 — изоамилбутират (изопентилбутират) имеют запах груш, а также служат растворителями в лаках для ногтей.
Эфиры изовалериановой кислоты:
(СH3)2CHCH2COOCH2CH2CH(CH3)2 — изоамилизовалерат (изопентилизовалерат) имеет запах яблока.
Применение в медицинеправить
В конце ХIХ — начале ХХ века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как мастнораэдражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
Альдегиды и кетоны
Функциональная группа альдегида — двухвалентная карбонильная группа связана с одним атомом водорода и углеводородным радикалом:
O || R-C-H
Функциональная группа кетона — двухвалентная карбонильная группа связана с двумя углеводородными радикалами:
O || R-C-R'
Альдегиды и кетоны получают в результате окисления спиртов. Альдегиды, имеющие в своей структуре бензольное кольцо, нашли широкое применение в парфюмерной промышленности, поскольку обладают приятным ароматом. Формальдегид (CH2=O) используется в качестве антисептика, а также в синтезе полимеров для получения фенопласта. Простейший кетон — ацетон (CH3-CO-CH3) является хорошим органическим растворителем, используется в лакокрасочной промышленности.
Изопропилацетат
Изопропилацетат является хорошим растворителем для нитроцеллюлозы. Скорость его испарения приблизительно в 3 раза меньше, чем у этилацетата и достаточно медленна для того, чтобы при сушке не появлялось помутнения пленки. Изопропилацетат применяется для приготовления пироксилиновых лаков. Этот эфир хорошо растворяет эфирные смолы ( резины), кумароновые смолы элеми, сандарак, мастик и каури. В нем частично растворяется шеллак; не растворимы: ацетилцеллюлоза и твердые копаловые смолы.
Изопропилацетат 641 — 644, 646 Изопропилглицидиловый эфир 243 N-Изопропиленизопропиламин 496 Изосульфизоксазол 488 ел.
Изопропилацетат — жидкость плотностью О. С); кипит при 88 4 С; в воде слабо растворима; 1 7 части воды растворяется в 10О частях эфира ( при 2О С), оба изомера хорошо растворяют смолы и нитроцеллюлозу и применяются как растворители. Изопропилацетат, кроме того, применяется как экстрагент в производстве уксусной кислоты.
Изопропилацетат 641 — 644, 646 Изопропилглицидиловый эфир 243 М — Изопропиленизопропиламин 496 Изосульфизоксазол 488 ел.
|
Форма хроматографического пятна образцов полистирола ( Mw 8 7 X X Ю5 в бензоле на силикагеле КСК. |
При добавлении менее полярного изопропилацетата эти образцы полностью разделяются. По значениям Rf в системе этилацетат — изопропилацетат их можно расположить в следующий ряд: изотактический
Выход хелатных титаносилоксанов и изопропилацетата при этом почти количественный. Смолообразные титано — или цирконо — силоксаны получены в результате реакций полифункциональных ацетоксисиланов с алкоксидами этих металлов.
С другой стороны, результаты исследования масс-спектра изопропилацетата свидетельствуют о ярко выраженном преобладании миграции водородов из положения 1 про-пильной группы.
Смесь 300 мг исследуемого сложного эфира ( например, изопропилацетата), 500 мг 3 5-динитробен-зоилхлорида и 3 мл пиридина выдерживают в течение 1 5 — 2 ч при слабом кипении с обратным холодильником. После охлаждения прибавляют при интенсивном перемешивании 10 мл 3 % — ной серной кислоты и встряхивают с 5 мл эфира, не содержащего спиртов Эфирную вытяжку отделяют и промывают последовательно 5 мл 3 % — ной серной кислоты, 4 мл 2 % — ного раствора едкого натра и 3 мл воды. Затем эфир отгоняют и остаток перекристаллизовывают из водно-спиртового раствора ( метилового или этилового спирта), при необходимости с добавлением угля.
Содержится в сточных водах производств ацетона, диизопропилового эфира, изопропилацетата, лаков и красок.
Содержится в сточных водах производств ацетона, диизопропилового эфира, изопропилацетата, лаков и красок, пластмасс, нефтехимических.
Применяется для синтеза ацетона, фенила, диизопропилового эфира, изопропилацетата и других соединений. Во многих случаях изопропиловый спирт заменяет этиловый спирт.
|
Подавление спин-спинового взаимодействия ( декашгарование, развязка метильных протонов изопропильной группы при облучении образца на частоте метинового сигнала.| Упрощение спектра в результате замещения протонов на дейтероны. |
Заметьте, что одна из метильных групп ( — О-С ( О) — СНЯ) изопропилацетата не расщепляется ни в одном из спектров; расщепление изопропильных метильных групп исчезает ( верхний спектр) при облучении центра метинового сигнала.
Применяют для получения ацетона каталитическим окислением, диизопропилового эфира ( высокооктановая добавка к авиабензинам), изопропилацетата ( растворитель, нитроцеллюлозных лаков), для синтеза тимола из метакрезола. Изопропиловый спирт может заменять во многих случаях этиловый спирт.
Физические свойства и строение
Диэтиловый эфир в бутылке
Физические свойства
Эфиры — бесцветные, подвижные, легкокипящие жидкости с характерным запахом. Эфиры малорастворимы в воде, но хорошо растворяются в органических растворителях и сами растворяют органические соединения.
Строение молекул
Валентный угол в молекулах простых эфиров
Строение молекул простых эфиров схоже со строением молекулы воды. Валентный угол С–O–C в диметиловом эфире составляет 112°. Атом кислорода имеет sp3-гибридизацию.
Спектральные свойства
Характеристической полосой простых эфиров в инфракрасном спектре является полоса при 1150–1080 см–1, соответствующая колебаниям группы C–O–C.
В спектрах 1Н ЯМР группа CH3O алкиловых эфиров имеет сигнал при 3,3-4,0 м. д., а та же группа метилариловых эфиров — при 3,7 м. д. Сигналы протонов двойной связи в виниловых эфирах (вида СН=СН–О) находятся при 5,7-7,5 м. д. (α-положение) и 3,5-5,0 м. д. (β-положение). Если сравнивать эти значения с положением сигналов в аналогичной углеводородной системе СН=СН–С, то сигнал α-углеродного атома оказывается смещённым на +1,2 м. д., а сигнал β-углеродного атома — на –1 м. д.
В спектрах 13C ЯМР насыщенных простых эфиров атом углерода, находящийся в α-положении от атома кислорода, даёт сигнал в области 50-100 м. д., а более удалённые атомы углерода — в области 10-60 м. д. У виниловых эфиров углероды двойной связи (С=С–О) дают сигналы при 115-165 м. д. (α-положение) и 70-120 м. д. (β-положение). При этом, если сравнивать спектры с углеводородными системами типа С=С–С, то сигнал α-углеродного атома в виниловых эфирах оказывается смещённым на +15 м. д., а сигнал β-углеродного атома — на –30 м. д. У ароматических простых эфиров сигнал α-углеродного атома кольца наблюдается при 135-155 м. д. (смещение +25 м. д. по сравнению с ареном). Сигналы остальных ароматических атомов углерода при введении эфирной группы смещаются на –15 м. д. (орто-положение), +1 м. д. (мета-положение) и –8 м. д. (пара-положение).
В масс-спектрах алифатических простых эфиров молекулярный ион проявляется в виде слабого сигнала, для ароматических простых эфиров — в виде интенсивного сигнала. Основное направление фрагментации молекулярного иона — разрыв связи между α- и β-углеродными атомами и гетеролитический разрыв связи C–O. В результате возникают ионы с массой (m/z), равной 31, 45, 59… М–46, М–33, М–18.
- R−CH2−O−R′+⋅→R⋅+CH2=O+−R′{\displaystyle {\mathsf {^{+\cdot }\rightarrow R^{\cdot }+CH_{2}\!\!=\!\!O^{+}\!\!-\!\!R’}}}
- R−O−R′+⋅→R−O⋅+R′+{\displaystyle {\mathsf {^{+\cdot }\rightarrow R\!\!-\!\!O^{\cdot }+R’^{+}}}}
Для алкилариловых простых эфиров фрагментация протекает через потерю алкильной цепи. У диариловых эфиров молекулярный ион или ион М–Н теряет группу CO, а также происходит разрыв связи между атомом кислорода и арильным заместителем. Также в ходе масс-спектрометрии простые эфиры претерпевают перегруппировки с отщеплением молекулы спирта либо — в случае ариловых простых эфиров — с отщеплением алкена и образованием фенола.
- PhOCH2CH2R+⋅→PhOH+⋅+CH2=CH−R{\displaystyle {\mathsf {^{+\cdot }\rightarrow ^{+\cdot }+CH_{2}\!\!=\!\!CH\!\!-\!\!R}}}
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ ВЕЩЕСТВ В ЗАВИСИМОСТИ ОТ СТРОЕНИЯ УГЛЕРОДНОЙ ЦЕПИ
Огромное разнообразие существующих сегодня органических веществ, а также потребность в синтезе новых соединений с заданными свойствами приводит к необходимости постоянного совершенствования и расширения системы классификации (систематизации). Органические вещества можно рассматривать как некий «пазл», в котором составные части должны идеально подходить друг к другу и к основе. Основой органического вещества является углеродный скелет, а составные части — это функциональные группы, гетероатомы, кратные связи. Классификация также необходима для того, чтобы правильно называть соединения, причем называть так, чтобы все химики понимали, о каком веществе идет речь. Поэтому классификация лежит в основе Международной номенклатуры органических соединений.
В основе классификации органических веществ можно выделить несколько основных подходов:
- Строение углеводородной цепи: замкнутые (циклические) и разомкнутые; линейные и разветвленные УВ.
- Наличие кратных связей: насыщенные или предельные (только одинарные связи) и ненасыщенные или непредельные (двойные и тройные связи) УВ.
- Наличие функциональных групп и замещающих атомов: кислородсодержащие, азотсодержащие, галлоидзамещенные УВ.
- Наличие гетероатома (N, O, S в структуре цикла): гетероциклические УВ.
- Биологическое (природное) происхождение: белки, жиры, углеводы, нуклеиновые кислоты, гормоны, витамины.
- Наличие в структуре соединений помимо C, H, N, O и S, других химических элементов, в том числе металлов: элементорганические (металлорганические) соединения.
Схема классификации в зависимости от строения углеродной цепи приведена на рисунке.
Некоторые соединения могут быть одновременно отнесены к нескольким классам. Например, 2-амино-1-гидрокси-4-нитробензол содержит сразу три функциональные группы, позволяющие отнести его к карбоциклическим (в основе лежит бензол), азотсодержащим (амино- и нитрогруппы) и кислородсодержащим (гидроксильная группа) соединениям.
ПОНЯТИЕ О ФУНКЦИОНАЛЬНОЙ ГРУППЕ
ОПРЕДЕЛЕНИЕ
Функциональная группа — это совокупность атомов, определяющая характерные химические свойства целого класса веществ.
Иногда к понятию функциональной группы относят также понятие радикал (метил, этил, пропил и т. д.). Однако хотя это и близкие понятия, но отличительным свойством функциональной группы является наличие одинаковых химических свойств, характерных для всего класса веществ, имеющих такую группу в своей структуре. С этой точки зрения алкильные радикалы такими свойствами не обладают.
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ ВЕЩЕСТВ ПО ТИПУ ФУНКЦИОНАЛЬНОЙ ГРУППЫ
По типу функциональных групп органические соединения делят на следующие классы (R-предельный углеводородный радикал):
| Функциональна группа | Класс соединений | Общая формула |
|---|---|---|
| Отсутствует | Углеводороды | R–H |
| Галоген –F, –Cl, –Br, –I | Галогеноводороды | R–Hal |
| Гидроксильная –OH | Спирты | R–OH |
| фенолы | Ar–OH (Ar=C6H5C6H5-) | |
| Алкоксильная –OR | Простые эфиры | R–O–R’ |
| Амино –NH2–NH2, –NH–, =N0 | Амины | R–NH2,R2NH,R3NR–NH2,R2NH,R3N |
| Нитро –NO2–NO2 | Нитросоединения | R–NO2R–NO2 |
| Карбонильная >C=O | Альдегиды | |
| Кетоны | ||
|
Карбоксильная (-COOH) |
Карбоновые кислоты | |
|
Алкоксикарбонильная(-COOR) |
Сложные эфиры | |
| Карбоксамидная (-CONH2CONH2) | Амиды карбоновых кислот | |
| Тиольная –SH | Тиолы | –RSH |
| Сульфо –SO3H–SO3H | Сульфоновые кислоты | –RSO3H–RSO3H |
Спирты: R-OH
Спирты являются производными предельных и непредельных углеводородов, в молекулах которых атом (атомы) водорода заменены гидроксильной группой (группами) -OH, которая определяет общие свойства всех спиртов. По этой причине, во многих случаях не имеет значения, какой будет остальная часть молекулы спирта, т.к. функциональная группа определяет общее поведение спиртов во многих химических реакциях.
Спирты принято обозначать общей формулой R-OH (R — остальная часть молекулы или углеводородный радикал). Названия спиртов заканчиваются на суффикс -ол, который заменяет суффикс -ан в названии соответствующего алкана.
Метанол (метиловый или древесный спирт) получают при помощи реакции синтеза из оксида углерода и водорода в присутствии катализатора при высоких значениях давления и температуры:
CO(г) + 2H2(г) → CH3OH(ж)
Метанол используют для производства формальдегида. Одно из перспективных направлений — использование метанола в качестве замены бензина.
Этанол (этиловый или винный спирт) получают из различных сахаристых веществ при помощи реакции брожения, вызываемой действием ферментов, которые вырабатывают дрожжевые грибки (данный способ получения спирта применяют для приготовления алкогольных напитков):
C6H12O6(р-р) → 2CH3CH2OH(ж) + 2CO2(г)
Второй способ получения этанола — синтез из этилена в присутствии катализаторов (этанол используют в качестве растворителя в парфюмерной и фармацевтической промышленности, в виде добавок к бензину для повышения октанового числа):
H2C = CH2+H2O → CH3-CH2-OH
Простые эфиры: R-O-R
Функциональную группу простых эфиров представляет один атом кислорода, связанный с двумя углеводородными группами.
Простые эфиры в химическом плане достаточно инертны, используются в качестве растворителей в органических реакциях. Вступая (медленно) в реакцию с атмосферным кислородом, простые эфиры образуют пироксиды, являющиеся взрывоопасными соединениями (именно по этой причине медики отказались от использования диэтилового эфира в качестве наркоза).
Получают простые эфиры с помощью реакции дегидратации спиртов. Например диэтиловый эфир синтезируют дегидратацией этилового спирта в присутствии серной кислоты:
2CH3CH2OH(ж) → CH3CH2-O-CH2CH3(ж) + H2O(ж)
Если использовать два разных спирта, то получится смешанный эфир, содержащий две разные группы -R.
Номенклатура сложных эфиров.
Название создается следующим образом: вначале указывается группа R, присоединенная к кислоте, затем – название кислоты с суффиксом «ат» (как и в названиях неорганических солей: карбонат натрия, нитрат хрома). Примеры на рис. 2
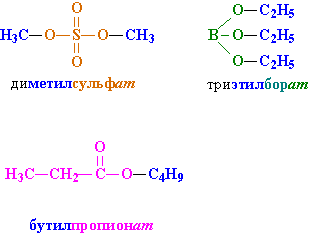
Рис. 2. НАЗВАНИЯ СЛОЖНЫХ ЭФИРОВ. Фрагменты молекул и соответствующие им фрагменты названий выделены одинаковым цветом. Сложные эфиры обычно рассматривают как продукты реакции между кислотой и спиртом, например, бутилпропионат можно воспринимать как результат взаимодействия пропионовой кислоты и бутанола.
Если используют тривиальное (см. ТРИВИАЛЬНЫЕ НАЗВАНИЯ ВЕЩЕСТВ) название исходной кислоты, то в название соединения включают слово «эфир», например, С3Н7СООС5Н11 – амиловый эфир масляной кислоты.
Получение
Межмолекулярная дегидратация спиртов
При нагревании первичных спиртов с концентрированной серной кислотой при 130-140 °С образуются простые эфиры. С точки зрения механизма реакции, происходит алкилирование спирта под действием катиона алкоксония ROH+2 или полуэфира серной кислоты ROSO3H.
- 2 CH3CH2OH→96% H2SO4, 135 ∘CCH3CH2OCH2CH3+H2O{\displaystyle {\mathsf {2~CH_{3}CH_{2}OH{\xrightarrow{96\;\%~H_{2}SO_{4},~135~^{\circ }C}}CH_{3}CH_{2}OCH_{2}CH_{3}+H_{2}O}}}
Этот метод пригоден для получения некоторых простейших эфиров: диэтилового, дипропилового, дибутилового эфиров, тетрагидрофурана и диоксана. Недостатком этого метода является то, что вторичные и третичные спирты в этих условиях дегидратируются, превращаясь в алкены. Также он не позволяет получать несимметричные простые эфиры из двух разных спиртов, поскольку при этом получается смесь трёх продуктов.
Промышленным вариантом этой реакции является дегидратация спиртов в газовой фазе над оксидом алюминия, бокситом и другими катализаторами при нагревании до 180-250 °С. Выход эфиров в таких процессах составляет до 75 %.
Реакция алкенов со спиртами
Спирты присоединяются к алкенам в присутствии кислотных катализаторов (серной, фосфорной кислоты, хлороводорода, фторида бора и др.), образуя простые эфиры.
- (CH3)2C=CH2+CH3OH→BF3, 100 ∘C(CH3)2C(OCH3)CH3{\displaystyle {\mathsf {(CH_{3})_{2}C\!\!=\!\!CH_{2}+CH_{3}OH{\xrightarrow{BF_{3},~100~^{\circ }C}}(CH_{3})_{2}C(OCH_{3})CH_{3}}}}
В промышленности таким способом получают простые эфиры из изобутилена либо изоамилена и метанола либо этанола, нагревая их над катионитом в кислой форме. При этом получают трет-бутилметиловый, трет-бутилэтиловый, трет-амилметиловый и <i>трет</i>-амилэтиловый эфиры.
В лабораторных условиях большее значение имеет реакция алкоксимеркурирования алкенов. Она аналогична реакции оксимеркурирования, при помощи которой алкены селективно превращают в спирты, однако в данном случае роль нуклеофильного реагента выполняет не вода, а спирт, который берут в качестве растворителя. Сам алкен вводят в реакцию с ацетатом ртути либо — для получения эфиров со вторичной или третичной алкильной группой — трифторацетатом ртути, а затем полученный продукт демеркурируют при помощи боргидрида натрия. Формально эта реакция представляет собой присоединения спирта по двойной связи согласно правилу Марковникова.
- RCH=CH2→Hg(OAc)2; EtOHRCH(OEt)−CH2−HgOAc→NaBH4RCH(OEt)−CH3{\displaystyle {\mathsf {RCH\!\!=\!\!CH_{2}{\xrightarrow{Hg(OAc)_{2};~EtOH}}RCH(OEt)\!\!-\!\!CH_{2}\!\!-\!\!HgOAc{\xrightarrow{NaBH_{4}}}RCH(OEt)\!\!-\!\!CH_{3}}}}
Реакция Вильямсона
Симметричные и несимметричные простые эфиры можно получить по реакции Вильямсона между алкоголятами и галогеналканами (либо сульфонатами). Эта реакция представляет собой нуклеофильное замещение по механизму SN2, и для неё верны соответствующие закономерности. Например, если в конечном продукте содержится вторичный или третичный заместитель, его следует вводить при помощи алкоголята, а не галогенида, поскольку в ином случае вместо замещения будет происходить реакция элиминирования. Наилучшими галогенидами в этой реакции являются первичные галогениды, а также аллил- и бензилгалогениды.
- (CH3)3COK+CH3I→(CH3)3COCH3{\displaystyle {\mathsf {(CH_{3})_{3}COK+CH_{3}I\rightarrow (CH_{3})_{3}COCH_{3}}}}
- CH3ONa+((CH3)3CCl→(CH3)2C=CH2+NaCl+CH3OH{\displaystyle {\mathsf {CH_{3}ONa+((CH_{3})_{3}CCl\rightarrow (CH_{3})_{2}C\!\!=\!\!CH_{2}+NaCl+CH_{3}OH}}}
Симметричные простые эфиры можно получить из двух молекул галогеналкана в присутствии оксида серебра(I). Так, например, поступают в случае ди-трет-бутилового эфира, который трудно получить другими способами: трет-бутилхлорид вводят в реакцию с карбонатом серебра.
Интерес к реакции Вильямсона связан также с получением краун-эфиров. В этих процессах катион металла в алкоголяте выполняет роль матрицы при сборке макроцикла. Радиус ионов лития, натрия и калия соответствует размеру полости в 12-краун-4, 15-краун-5 и 18-краун-6, и наличие этих катионов сильно повышает выход соответствующих краун-эфиров.
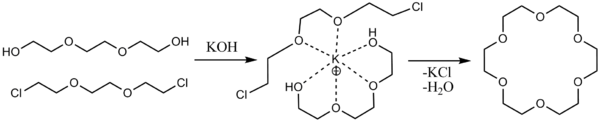
Другие методы
Метиловые простые эфиры получают по реакции спиртов с диазометаном в присутствии кислот Льюиса (фторида бора, хлорида алюминия и др.).
- ROH+CH2N2→Al(OR′)3ROCH3{\displaystyle {\mathsf {ROH+CH_{2}N_{2}{\xrightarrow{Al(OR’)_{3}}}ROCH_{3}}}}
Амины
Аминами называют производные аммиака, в которых один, два или все три атома водорода замещены на углеводородный радикал.
Амины, в которых только один атом водорода замещен на углеводородный радикал, т.е. имеющие общую формулу R-NH2, называют первичными аминами.
Амины, в которых два атома водорода замещены на углеводородные радикалы, называют вторичными аминами. Формулу вторичного амина можно записать как R-NH-R’. При этом радикалы R и R’ могут быть как одинаковые, так и разные. Например:
| СH3-NH-CH3 | СH3-NH-CH2-CH3 |
| диметиламин | метилэтиламин |
Если в аминах отсутствуют атомы водорода при атоме азота, т.е. все три атома водорода молекулы аммиака замещены на углеводородный радикал, то такие амины называют третичными аминами. В общем виде формулу третичного амина можно записать как:
При этом радикалы R, R’, R’’ могут быть как полностью одинаковыми, так и все три разные.
Общая молекулярная формула первичных, вторичных и третичных предельных аминов имеет вид CnH2n+3N.
Ароматические амины с только одним непредельным заместителем имеют общую формулу CnH2n-5N
Классификация и состав сложных эфиров.
Среди изученных и широко применяемых сложных эфиров большинство представляют соединения, полученные на основе карбоновых кислот. Сложные эфиры на основе минеральных (неорганических) кислот не столь разнообразны, т.к. класс минеральных кислот менее многочисленен, чем карбоновых (многообразие соединений – один из отличительных признаков органической химии).
Когда число атомов С в исходных карбоновой кислоте и спирте не превышает 6–8, соответствующие сложные эфиры представляют собой бесцветные маслянистые жидкости, чаще всего с фруктовым запахом. Они составляют группу фруктовых эфиров. Если в образовании сложного эфира участвует ароматический спирт (содержащий ароматическое ядро), то такие соединения обладают, как правило, не фруктовым, а цветочным запахом. Все соединения этой группы практически нерастворимы в воде, но легко растворимы в большинстве органических растворителей. Интересны эти соединения широким спектром приятных ароматов (табл. 1), некоторые из них вначале были выделены из растений, а позже синтезированы искусственно.
| Табл. 1. НЕКОТОРЫЕ СЛОЖНЫЕ ЭФИРЫ, обладающие фруктовым или цветочным ароматом (фрагменты исходных спиртов в формуле соединения и в названии выделены жирным шрифтом) | ||
| Формула сложного эфира | Название | Аромат |
| СН3СООС4Н9 | Бутилацетат | грушевый |
| С3Н7СООСН3 | Метиловый эфир масляной кислоты | яблочный |
| С3Н7СООС2Н5 | Этиловый эфир масляной кислоты | ананасовый |
| С4Н9СООС2Н5 | Этиловый эфир изовалериановой кислоты | малиновый |
| С4Н9СООС5Н11 | Изоамиловый эфир изовалериановой кислоты | банановый |
| СН3СООСН2С6Н5 | Бензилацетат | жасминовый |
| С6Н5СООСН2С6Н5 | Бензилбензоат | цветочный |
При увеличении размеров органических групп, входящих в состав сложных эфиров, до С15–30 соединения приобретают консистенцию пластичных, легко размягчающихся веществ. Эту группу называют восками, они, как правило, не обладают запахом. Пчелиный воск содержит смесь различных сложных эфиров, один из компонентов воска, который удалось выделить и определить его состав, представляет собой мирициловый эфир пальмитиновой кислоты С15Н31СООС31Н63. Китайский воск (продукт выделения кошенили – насекомых Восточной Азии) содержит цериловый эфир церотиновой кислоты С25Н51СООС26Н53. Кроме того, воски содержат и свободные карбоновые кислоты и спирты, включающие большие органические группы. Воски не смачиваются водой, растворимы в бензине, хлороформе, бензоле.
Третья группа – жиры. В отличие от предыдущих двух групп на основе одноатомных спиртов ROH, все жиры представляют собой сложные эфиры, образованные из трехатомного спирта глицерина НОСН2–СН(ОН)–СН2ОН. Карбоновые кислоты, входящие в состав жиров, как правило, имеют углеводородную цепь с 9–19 атомами углерода. Животные жиры (коровье масло, баранье, свиное сало) – пластичные легкоплавкие вещества. Растительные жиры (оливковое, хлопковое, подсолнечное масло) – вязкие жидкости. Животные жиры, в основном, состоят из смеси глицеридов стеариновой и пальмитиновой кислоты (рис. 3А,Б). Растительные масла содержат глицериды кислот с несколько меньшей длиной углеродной цепи: лауриновой С11Н23СООН и миристиновой С13Н27СООН. (как и стеариновая и пальмитиновая – это насыщенные кислоты). Такие масла могут долго храниться на воздухе, не меняя своей консистенции, и потому называются невысыхающими. В отличие от них, льняное масло содержит глицерид ненасыщенной линолевой кислоты (рис. 3В). При нанесении тонким слоем на поверхность такое масло под действием кислорода воздуха высыхает в ходе полимеризации по двойным связям, при этом образуется эластичная пленка, не растворимая в воде и органических растворителях. На основе льняного масла изготавливают натуральную олифу.
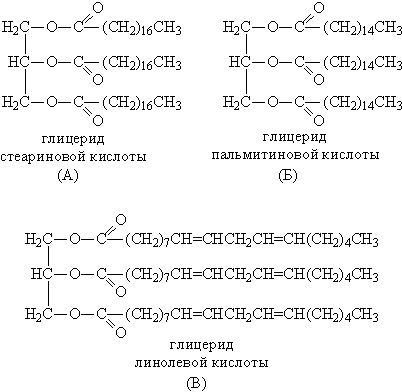
Рис. 3. ГЛИЦЕРИДЫ СТЕАРИНОВОЙ И ПАЛЬМИТИНОВОЙ КИСЛОТЫ (А И Б) – компоненты животного жира. Глицерид линолевой кислоты (В) – компонент льняного масла.
Сложные эфиры минеральных кислот (алкилсульфаты, алкилбораты, содержащие фрагменты низших спиртов С1–8) – маслянистые жидкости, эфиры высших спиртов (начиная с С9) – твердые соединения.
Применение сложных эфиров.
Этилформиат НСООС2Н5 и этилацетат Н3СООС2Н5 используются как растворители целлюлозных лаков (на основе нитроцеллюлозы и ацетилцеллюлозы).
Сложные эфиры на основе низших спиртов и кислот (табл. 1) используют в пищевой промышленности при создании фруктовых эссенций, а сложные эфиры на основе ароматических спиртов – в парфюмерной промышленности.
Из восков изготавливают политуры, смазки, пропиточные составы для бумаги (вощеная бумага) и кожи, они входят и в состав косметических кремов и лекарственных мазей.
Жиры вместе с углеводами и белками составляют набор необходимых для питания пищевых продуктов, они входят в состав всех растительных и животных клеток, кроме того, накапливаясь в организме, играют роль энергетического запаса. Из-за низкой теплопроводности жировой слой хорошо предохраняет животных (в особенности, морских – китов или моржей) от переохлаждения.
Животные и растительные жиры представляют собой сырье для получения высших карбоновых кислот, моющих средств и глицерина (рис. 4), используемого в косметической промышленности и как компонент различных смазок.
Нитроглицерин (рис. 4) – известный лекарственный препарат и взрывчатое вещество, основа динамита.
На основе растительных масел изготавливают олифы (рис. 3), составляющие основу масляных красок.
Эфиры серной кислоты (рис. 2) используют в органическом синтезе как алкилирующие (вводящие в соединение алкильную группу) реагенты, а эфиры фосфорной кислоты (рис. 5) – как инсектициды, а также добавки к смазочным маслам.
Михаил Левицкий