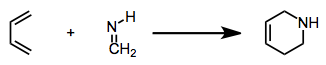Номенклатура органических соединений
Содержание:
Реакции имина
Самые важные реакции иминов — свой гидролиз к соответствующему амину и карбонильному составу. Иначе эта функциональная группа участвует во многих других реакциях, многие из которых походят на реакции альдегидов и кетонов.
- Имин реагирует с амином на aminal, посмотрите, например, синтез cucurbituril.
- Имин реагирует с диенами в реакции Diels-ольхи Aza на tetrahydropyridine.
- Имин может быть окислен с meta-chloroperoxybenzoic кислотой (mCPBA), чтобы дать oxaziridine
- Ароматический имин реагирует с enol эфиром на quinoline в реакции Поварова.
- tosylimine реагирует с α,β-unsaturated карбонильный состав к allylic амину в реакции Aza-Baylis–Hillman.
- Имины — промежуточные звенья в алкилировании аминов с муравьиной кислотой в реакции Эшвайлера-Clarke.
- Перестановка в химии углевода, включающей имин, является перестановкой Amadori.
- Реакция передачи метилена имина неустойчивым sulphonium ylide может дать aziridine систему.
- Имин — промежуточное звено в возвращающем аминировании.
Кислотно-щелочные реакции
Несколько как родительские амины, имины мягко основные и обратимо присоединяют протон, чтобы дать соли iminium. Производные Iminium особенно восприимчивы к сокращению к аминам, используя гидрирование передачи или стехиометрическим действием натрия cyanoborohydride. Так как имины, полученные из несимметрических кетонов, являются prochiral, их сокращение — полезный метод для синтеза chiral аминов.
Как лиганды
Имины — общие лиганды в химии координации. Уплотнение salicylaldehyde и ethylenediamine дает семьи содержащего имин chelating агенты, такие как Сален.
Сокращения имина
Имин может быть уменьшен до амина через гидрирование, например, в синтезе m-tolylbenzylamine:
Другие уменьшающие агенты — литиевый алюминиевый гидрид и борогидрид натрия.
первом асимметричном сокращении имина сообщил в 1973 Kagan, используя Ph (Меня) C=NBn и PhSiH в hydrosilylation с chiral лигандом DIOP и катализатор родия (RhCl (CHCH)). Много систем были с тех пор исследованы.
7.4. Установление градуированной характеристики
Градуировочные
характеристики устанавливают на градуировочных растворах акрилонитрила,
ацетонитрила, диметиламина, диметилформамида, диэтиламина, пропиламина,
триэтиламина и этиламина (эффективность сорбции на сорбенте более 95 %) методом
абсолютной градуировки. Они выражают зависимость площади пика соответствующего
вещества на хроматограмме (мм2 — при ручном расчете или мВ с — при
автоматическом обсчете с использованием программно-аппаратного комплекса) от
содержания (мкг) по 6-ти сериям растворов для градуировки. Каждая серия состоит
из 6 растворов.
Градуировочные
растворы диметиламина, диметилформамида и этиламина готовят в мерных колбах
вместимостью 100 см3. Для этого в каждую колбу вносят рабочий
раствор № 1 для градуировки в соответствии с табл. , доводят объем этанолом до
метки и тщательно перемешивают.
Градуировочные
растворы акрилонитрила и диэтиламина готовят в мерных колбах вместимостью 100
см3. Для этого в каждую колбу вносят исходный раствор № 2 для
градуировки в соответствии с табл. , доводят объем этанолом до
метки и тщательно перемешивают.
Градуировочные
растворы ацетонитрила, пропиламина и триэтиламина готовят в мерных колбах
вместимостью 100 см3. Для этого в каждую колбу вносят исходный раствор
№ 3 для градуировки в соответствии с табл. , доводят объем этанолом до
метки и тщательно перемешивают. Срок хранения всех градуировочных растворов — 1
неделя.
На сорбент
через узкое отверстие в сорбционной трубке на глубину 5 — 8 мм вводят 1 мм3
одного из градуировочных растворов. Затем вставляют трубку (широким концом) в
уплотняющее кольцо съемной крышки испарителя, соединенной с четырехходовым
краном; прерывают поток газа-носителя этим краном. Отвернув крышку на
испарителе, быстро вводят в него трубку, закрывают испаритель дополнительной
крышкой и одновременно включают секундомер. Через 10 с поворачивают
кран-переключатель и газ-носитель, проходя через крышку испарителя, выталкивает
смесь из трубки в хроматографическую колонку. Определение соединений проводят
на одной из рекомендуемых колонок в следующих условиях:
температура
термостата колонки № 1 программируется от 70 °С (8 мин изотерма) до 140 °С (20
мин изотерма) со скоростью 5 град/мин;
температура термостата
колонки № 2 программируется от 90 °С (8 мин изотерма) до 140 °С (20 мин
изотерма) со скоростью 5 град/мин;
температура испарителя210
°С;
температура детектора210
°С;
расход газа-носителя (азота)20
см3/мин.
Таблица 2
Растворы
для установления градуировочной характеристики при определении концентраций
диметиламина, диметилформамида и этиламина
1
2
3
4
5
6
Объем рабочего раствора № 1 (с = 0, 1 мг/см3),
см3
2,0
5,0
10,0
60,0
100,0
Содержание вещества, мкг в 1 мм3
0,002
0,005
0,01
0,06
0,1
Таблица 3
Растворы
для установления градуировочной характеристики при определении концентраций
акрилонитрила и диэтиламина
1
2
3
4
5
6
Объем исходного раствора № 2 (с = 10 мг/см3),
см3
0,1
0,4
1,0
6,0
10,0
Содержание вещества, мкг в 1 мм3
0,01
0,04
0,1
0,6
1,0
Таблица 4
Растворы
для установления градуировочной характеристики при определении концентраций
ацетонитрила, пропиламина и триэтиламина
1
2
3
4
5
6
Объем исходного раствора № 3 (с = 10 мг/см3),
см3
0,5
1,0
5,0
10,0
20,0
Содержание вещества, мкг в 1 мм3
0,05
0,1
0,5
1,0
2,0
Шкала измерителя тока усилителя детектора — 2 ´ 1010 А;
скорость движения диаграммной ленты — 240 мм/ч;
время удерживания компонентов на колонке № 1:
· диметиламин — 6 мин 48 с, этиламин — 9 мин
04 с, пропиламин — 12 мин 55 с, ацетонитрил — 13 мин 28 с, акрилонитрил — 15
мин 10 с, диэтиламин — 16 мин 34 с, триэтиламин — 21 мин 32 с, диметилформамид
— 27 мин 02 с;
время
удерживания компонентов на колонке № 2:
· диметиламин — 3 мин 37 с, этиламин — 4 мин 09
с, пропиламин — 5 мин 25 с, ацетонитрил — 9 мин 54 с, диэтиламин — 10 мин 01 с,
акрилонитрил — 11 мин 09 с, триэтиламин — 14 мин 55 с, диметилформамид — 34 мин
21 с.
На полученных
хроматограммах рассчитывают площади пиков компонентов и по средним результатам
из 5-ти измерений строят градуировочные характеристики. Градуировку проводят 1
раз в месяц и при смене реактивов.
Задания на амины повышенной сложности.
Задание №1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
CH3NO2 X1 X2 X3 X2 X4
Задание №2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
X1 X2 X3 X4
Задание №3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
C2H5Cl X1 X2 X3 X2 CO2
Задание №4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
CH3COOH X1 X2 X3 X4
Задание №5
Навеску неизвестного азотсодержащего соединения массой 10,7 г сожгли в избытке кислорода и получили 15,68 л углекислого газа, 8,1 г воды и 1,4 г азота. Определите молекулярную формулу данного соединения и его структуру, если известно, что оно имеет циклическое строение, содержит только один заместитель в кольце, а также реагирует с азотистой кислотой с выделением газа.
n(CO2) = V(CO2)/Vm = 15,68/22,4 = 0,7 моль, следовательно, n(C) = n(CO2) = 0,7 моль,
m(C) = n(C)·M(C) = 0,7·12 = 8,4 г,
n(H2O) = m(H2O)/M(H2O) = 8,1/18 = 0,45 моль, следовательно, n(H) = 2n(H2O) = 2·0,45 = 0,9 моль,
m(H) = n(H)·M(H) = 0,9·1 = 0,9 г,
n(N2) = m(N2)/M(N2) = 1,4/28 = 0,05 моль, следовательно, n(N) = 2n(N2) = 2·0,05 = 0,1 моль,
m(N) = n(N)·M(N) = 0,1·14 = 1,4 г,
m(O) = m(в-ва) — m(С) — m(H) — m(N) = 10,7 — 8,4 — 0,9 — 1,4 = 0 г, следовательно, кислорода в соединении нет.
n(C):n(H):n(N) = 0,7:0,9:0,1 = 7:9:1
Таким образом, простейшая формула искомого соединения C7H9N.
Если предположить, что истинная молекулярная формула совпадает с простейшей, то искомое соединение может являться ароматическим амином. Под формулу C7H9N подходят 4 соединения: о-метиланилин, м-метиланилин, п-метиланилин, а также бензиламин.
Поскольку в условии сказано, что соединение содержит только один заместитель в цикле, это означает, что подходит только бензиламин, структурная формула которого:
Задание №6
При сжигании навески неизвестного азотсодержащего вещества массой 10,3 г образовалось 8,96 л углекислого газа, 1,12 л азота и 8,1 г воды. Определите молекулярную формулу вещества и его структуру, если известно, что оно не реагирует с содой, а при его гидролизе образуется простейший одноатомный спирт и вещество природного происхождения.
n(CO2) = V(CO2)/Vm = 8,96/22,4 = 0,4 моль, следовательно, n(C) = n(CO2) = 0,4 моль,
m(C) = n(C)·M(C) = 0,4·12 = 4,8 г,
n(N2) = V(N2)/Vm = 1,12/22,4 = 0,05 моль, следовательно, n(N) = 2n(N2) = 2·0,05 = 0,1 моль,
m(N) = n(N)·M(N) = 0,1·14 = 1,4 г,
n(H2O) = m(H2O)/M(H2O) = 8,1/18 = 0,45 моль, следовательно, n(H) = 2·n(H2O) = 2·0,45 = 0,9 моль,
m(H) = n(H)·M(H) = 0,9·1 = 0,9 г,
m(O) = m(в-ва) — m(С) — m(H) — m(N) = 10,3 — 4,8 — 0,9 — 1,4 = 3,2 г,
n(O) = m(O)/M(O) = 3,2/16 = 0,2 моль,
n(C):n(H):n(O):n(N) = 0,4:0,9:0,2:0,1 = 4:9:2:1,
Таким образом, простейшая формула искомого соединения C4H9O2N.
Простейший одноатомный спирт – это метанол.
Если предположить, что истинная молекулярная формула совпадает с простейшей, то искомое соединение может являться сложным эфиром метанола и аланина, структурная формула которого:
Задание №7
Навеску неизвестного азотсодержащего соединения массой 13,2 г сожгли в избытке кислорода. В результате образовалось 8,96 л углекислого газа, такое же количество вещества воды, а также 2,24 л азота. Определите молекулярную формулу данного соединения и установите его строение, если известно, что оно гидролизуется под действием раствора едкого натра с образованием единственного соединения.
n(N2) = V(N2)/Vm = 2,24/22,4 = 0,1 моль, следовательно, n(N) = 2n(N2) = 2·0,1 = 0,2 моль,
m(N) = n(N)·M(N) = 0,2·14 = 2,8 г,
n(CO2) = V(CO2)/Vm = 8,96/22,4 = 0,4 моль, следовательно, n(C) = n(CO2) = 0,4 моль,
m(C) = n(C)·M(C) = 0,4·12 = 4,8 г,
По условию, n(H2O) = n(CO2) = 0,4 моль,
n(H) = 2·n(H2O) = 2·0,4 = 0,8 моль,
m(H) = n(H)·M(H) = 1·0,8 = 0,8 моль,
m(O) = m(в-ва) — m(С) — m(H) — m(N) = 13,2 — 4,8 — 0,8 — 2,8 = 4,8 г,
n(O) = m(O)/M(O) = 4,8/16 = 0,3 моль,
n(C):n(H):n(O):n(N) = 0,4:0,8:0,3:0,2 = 2:4:1,5:1 = 4:8:3:2
Таким образом, простейшая формула искомого соединения C4H8O3N2.
Если предположить, что истинная молекулярная формула совпадает с простейшей, то искомое соединение может представлять собой дипептид глицилглицин:
Применение
Препараты на основе вещества рекомендуются для опрыскивания посевов ржи, пшеницы, овса, ячменя для борьбы с однолетними двудольными сорняками в фазе кущения до выхода в трубку. Не рекомендуется использовать препарат, если культуры находятся в стрессовом состоянии, вызванном заморозками, подтоплением, засухой, осенью, если ожидаются заморозки.
Лучший эффект от применения препарата может быть достигнут в интервале температур 8-25 градусов. Максимальный результат обеспечивается, если обработка однолетних сорных растений происходит в стадии семядольных – 2-3х настоящих листьев, многолетних – в стадии розетки, имеющей диаметр 5-8 см.
Зарегистрированные препараты на основе МЦПА (диметиламинная соль) применяются против однолетних и некоторых многолетних (виды осота) двудольныхсорняков на посевахржи, овса, пшеницы яровой и озимой, ячменя ярового и озимого.
Баковые смеси. Прозводитель утверждает, что препарат хорошо сочетается с гербицидами, действующие вещества которых относятся к группе сульфонилмочевин, может применяться с препаратами на основе клопиралида, 2,4-Д, бромоксинила, дикамбы.
Водный раствор — диметиламин
В мерную колбу емкостью 50 мл вносят 20 мл этилового спирта и 0 06 мл уксусной кислоты и взвешивают на аналитических весах, затем добавляют примерно 0 1 мл водного раствора диметиламина и снова взвешивают.
Разработан метод получения 40 % — ных водных растворов диметиламинной соли 2М — 4Х и 2М — 4ХП кислот путем экстрагирования последних непосредственно из хлормассы 10 % — ным водным раствором диметиламина при комнатной температуре и последующего упаривания экстракта до требуемой по техническим условиям концентрации.
Мы предприняли изучение условий диметиламинометилирования ( i-нафтола, причем в качестве диметиламинометилирующего агента мы взяли бис — ( диметиламино) — метан, полученный йо Анри , а также смесь водных растворов диметиламина и формальдегида в различных соотношениях. Оказалось, чго, вопреки утверждениям Декомба
К суспензии 0 71 моля бисульфита натрия в 150 мл воды при перемешивании добавляют 0 71 моля / г-хлорбензальдегида, а затем через 15 мин — 128 г 25 % — ного водного раствора диметиламина. После удаления ледяной бани продолжают перемешивание в течение 3 ч, а затем фильтруют смесь.
С этой целью была смонтирована лабораторная установка для непрерывного хлорирования 2-метилфенокси-я — пропионовой кислоты ( КПК) и непрерывного экстрагирования получающейся при хлорировании 2М — 4ХП — кислоты непосредственно из хлормассы водными растворами диметиламина ( ДМА) различной концентрации. Полученный таким образом экстракт аминной соли 2М — 4ХП упаривают периодическим способом до требуемой по техническим условиям концентрации.
Очистку осуществляют в колонне. Дистиллат представляет собой водный раствор диметиламина, который после концентрирования может быть использован в производстве.
Получают взаимодействием 2-меркаптобензо-тиазола с водным раствором диметиламина.
Получают в результате взаимодействия меркаптобензотиазола с водным раствором диметиламина.
Смесь сероуглерода, лаурилеульфата и воды облучают ультразвуком с частотой 23 кГц и мощностью 150 Вт в течение 30 мин для получения гомогенной эмульсии. Добавляют по каплям 40 % — ими водный раствор диметиламина и 25 % — ный раствор N3011 в течение 20 мин.
Это свидетельствует о высокой чувствительности атома углерода к нуклео-фильной атаке. В аналогичных условиях соединения XLIII и XLIV с водным раствором диметиламина тоже дают один продукт — 4 6-бмс — ( диметиламино) — пиразоло
К фильтрату ацетонового экстракта добавляют 10 % — и водный раствор диметиламина. Образующееся красное окрашивание ( максимум поглощения 495 ммк), интенсивность которого остается неизменной в течение 15 мин. Лейн ( Lane, 1959) развил и усовершенствовал эту методику. Им предложено экстрагировать пестицид бензолом и обрабатывать фильтрат экстракта безводным диметиламином. Последующее фотометриро-вание обеспечивает количественное определение с чувствительностью 0.5 мкг. Метод позволяет открывать в среднем 90 % вещества.
К 920 г ( 5 1 моля) 25 % — ного водного раствора диметиламина прибавляют по частям 431 г ( 1 5 моля) неочищенного хлорангидрида 4 — ( р-бромэтил) бензолсульфокислоты. Смесь хорошо перемешивают в течение 2 час. Прибавляют к реакционной смеси равный объем воды и сливают водный слой, после чего прибавлю 500 мл бензола. Полученный раствор промывают водой и сушат хлорисым кальцием в течение ночи. Отгоняют бензол под уменьшенным давлением и получают коричневое масло, которое при стоянии частично затвердевает. Твердую часть отделяют на воронке для фильтрования с отсасыванием; выход неочищенного М М — диметиламида 4 — ( р-бромэтил) бензолсульфокислоты равен 113 г ( 25 % от теорет.
Диметилкарбаматы получают при реакции гидрок-сильных соединений с растворенным в толуоле диме-тилкарбамоилхлоридом в присутствии основания, например карбоната калия. Раствор диметилкарбамоил-хлорида в толуоле получают при реакции фосгена в растворе толуола с водным раствором диметиламина, слой толуэна отделяют и сепарируют и используют без дальнейшей очистки.
Найдено, что наиболее удобно вести реакцию, дей-ствуя на — нафтол водными растворами диметиламина и формальдегида. Добавки уксусной кислоты ускоряют процесс, но увеличивают количество смолообразных продуктов реакции.
На следующей стадии бензилиденовое производное ( 3) подвергается обменной реакции с формальдегидом. В качестве примера этой реакции можно привести получение 5-метилфурфурилдиметиламина из смеси 40 % — ного водного раствора диметиламина, формалина, уксусной кислоты и 2-метилфурана.
Хронология Править
Арка Нарушители в Великом СклепеПравить
- Основная статья: Арка Нарушители в Великом Склепе
Дожидаясь Арче, Робердика и Хеккерана в таверне «Поющее яблоко» Имина встречает ростовщика, который ищет Арче. Он решает дождаться Хеккерана, что бы лично узнать от него где она, но Хеккеран не долго думая заканчивает разговор, грубо говоря ему уйти. Очень скоро вся команда собирается вместе и завязывается разговор о человеке, который искал Арче. Группа узнаёт о тяжёлом положении семьи Арче и в конце беседы, посоветовавшись со своими компаньонами, они решают принять заказ графа Фемела и часть денег отдать в долг Арче, чтобы та погасила часть залога должника.
Прибыв к пункту назначения они проникают в Великую Гробницу Назарик и обнаруживают там колоссальное количество сокровищ. Далее, они принимают решение спуститься глубже, где встречают хозяина Гробницы — Аинз Оал Гоуна. В итоге, Аинз применяет на всей команде паралич (кроме Арче) и те падают из-за неспособности контролировать свои тела, а после погибают.
Номенклатура и классификация
Имины связаны с кетонами и альдегидами заменой кислорода с НОМЕРОМ группы. Когда R = H, состав — основной имин, когда R — hydrocarbyl, состав — вторичный имин. Имины показывают разнообразную реактивность и обычно сталкиваются всюду по химии. Когда R, О, имин называют oxime, и когда R — NH, имин называют hydrazone.
Основной имин, в котором C присоединен и к hydrocarbyl и к H, называют основным aldimine; вторичный имин с такими группами называют вторичным aldimine. Основной имин, в котором C присоединен к двум hydrocarbyls, называют основным ketimine; имин с такими группами называют вторичным ketimine.
File:Aldimine — (основной)-skeletal.png|Primary aldimine
File:Aldimine — (вторичный)-skeletal.png|Secondary aldimine
File:Imine — (основной)-skeletal.png|Primary ketimine
File:Imine — (вторичный)-skeletal.png|Secondary ketimine
Один способ назвать aldimines состоит в том, чтобы взять имя радикала, удалить финал «e» и добавить «-имин», например ethanimine. См. aldimine статью для других соглашений обозначения. Поочередно, имин называют как производная карбонила, добавляя слово «имин» к названию карбонильного состава, oxo группа которого заменена imino группой, например sydnone имин и имин ацетона (промежуточное звено в синтезе ацетона azine).
Имины N-Sulfinyl — специальный класс иминов, прилагающих sulfinyl группу к атому азота.
Реакционная способность
Атом азота в иминах слабонуклеофилен, атом углерода — электрофилен.
Имины обладают слабоосновными свойствами и в отсутствие воды могут протонироваться и алкилироваться по атому азота с образованием иминиевых солей:
- R2C=NR1 + R2Hal →{\displaystyle \to } R2C=N+R1R2•Hal−
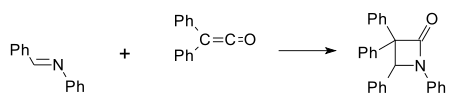
Иминиевые соли также образуются при алкилировании и ацилировании иминов, продукты алкилирования могут быть выделены, в случае ацилирования промежуточно образующиеся ацилиминиевые соли циклизуются в β-лактамы (азетидин-2-оны)
Реакции иминов с нуклеофилами протекают по атому углерода, весьма разнообразны и широко используются в органическом синтезе.
Так, имины гидролизуются водой с образованием карбонильных соединений и аминов, эта реакция обратна реакции синтеза иминов:
- R2C=NR1 + H2O →{\displaystyle \to } R2C=O + R1NH2
Реакции иминов с аминами приводят к образованию аминалей (гем-диаминов):
- R2C=NR1 + R1NH2→{\displaystyle \to } R2C(NR1)2
Реакция иминов с цианистым водородом либо триметилсилилцианидом является вариантом реакции Штреккера и, в случае N-замещенных иминов, может служить методом синтеза N-замещенных α-аминокислот:
- R2C=NR1 + HCN →{\displaystyle \to } R2C(NHR1)CN
- R2C(NHR1)CN + 2H2O →{\displaystyle \to } R2C(NHR1)COOH + NH3
Взаимодействие реактивов Гриньяра и литийорганических соединений с иминами ведет к C-алкилированию последних с образованием аминов:
- R2C=NR1 + R2Li →{\displaystyle \to } R2R2CN− R1 Li+
- R2R2CN− R1 Li+ + H2O →{\displaystyle \to } R2R2CNHR1 + LiOH
Имины вступают в различные реакции циклоприсоединения, образуя с карбенами продукты (2+1)-циклоприсоединения — азиридины, с кетенами идет (2+2)-циклоприсоединение с образованием азетидин-2-оны (синтез β-лактамов по Штаудингеру, формально — ацилирования иминов кетенами):
С 1,3-диполярными соединениями (диазометаном, нитрилоксидами) образуются пятичленные гетероциклы — продукты (2+3)-циклоприсоединения.
Имины также могут выступать в роли диенофилов в реакции Дильса-Альдера:
Под действием энергичных восстановителей (алюмогидрид лития, борогидрид натрия, водород над никелем Ренея и т. п.) имины восстанавливаются до вторичных аминов:
- R2C=NR1 + →{\displaystyle \to } R2CH-NHR1
Имины, образованные из енолизирующихся карбонильных соединений, способны к имин-енаминной таутомерии:
Синтез
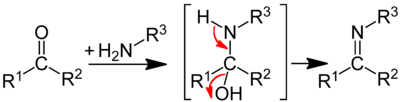
Традиционным методом синтеза иминов является конденсация альдегидов и кетонов с первичными аминами. На первой стадии происходит нуклеофильная атака аминогруппы по электрофильному карбонильному атому углерода с образованием неустойчивого гем-аминоспирта, который далее дегидратируется до имина:
В случае альдегидов, несущих сильные электронакцепторные заместители при альдегидной группе (хлораль, гексафторацетон и т. п.), образуются стабильные гем-аминоспирты.
Имины также могут быть синтезированы окислением вторичных аминов надкислотами:
- R2CH-NHR1 + →{\displaystyle \to } R2C=NR1 + H2O
или через образование N-хлораминов с дальнейшим отщеплением от них хлороводорода:
- R2CH-NClR1 + OH−→{\displaystyle \to } R2C=NR1 + H2O + Cl−
Специфическим методом синтеза α-оксоиминов является термическое разложение в инертном растворителе α-азидокетонов, получаемых взаимодействием α-галогенкетонов с азидом натрия:
- RCOCH2Hal + NaN3→{\displaystyle \to } RCOCH2N3 + NaHal
- RCOCH2N3→{\displaystyle \to } RCOCH=NH + N2
Аналогичным образом происходит разложение функционализированных α-азидокетонов под действием аминов, в этом случае реакция сопровождается конденсацией амина с карбонильным фрагментом, что ведет к образованию 1,2-дииминов, таутомеризующихся далее в γ-имино-β-енамины:
- RCOCH(N3)CH2COOEt + R’NH2→{\displaystyle \to } RC(=NR’)C(=NH)CH2COOEt
- RC(=NR’)C(=NH)CH2COOEt →{\displaystyle \to } RC(=NR’)C(NH2)=CHCOOEt
Статья составлена с использованием следующих материалов:
Ганиев М.М., Недорезков В.Д. Химические средства защиты растений. – М.: КолосС, 2006. – 248 с.
2.
Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации, 2013 год. Министерство сельского хозяйства Российской Федерации (Минсельхоз России)
3.
Дикопур МЦПА, в.р. Паспорт безопасности № 1907/2006. Дата выпуска готовой спецификации 7.11.2012. Nufarm
4.
Плантовский вестник, №2, апрель-май 2011, с.18-19. ПЛАНТА аграрные технологии
Источники из сети интернет:
5.
Агроксон. Сайт производителя http://www.cheminova.ru/
Свернуть
Список всех источников
3.1. Средства измерений
Хроматограф с АФД
Барометр анероид М-67ТУ
2504-1797-75
Весы аналитические
лабораторные ВЛА-200ГОСТ
24104-80Е
Линейка измерительнаяГОСТ 17435-72
Лупа измерительнаяГОСТ
8309-75
Меры массыГОСТ
7328-82Е
Шприцы на 1,10 мм3
и 0,25 см3
фирмы Hamilton
(Швейцария)
Посуда мерная стекляннаяГОСТ
1770-74Е
Программно-аппаратный
комплекс
«ЭКОХРОМ» для регистрации и
обсчета хроматограммТУ
5Е2.148.003
Секундомер СДС пр-1-2-000ГОСТ
5072-79
Термометр метеорологический
ТМ-1ГОСТ
112-78Е
Малогабаритный пробоотборник
модели 222-3
фирмы Skc Inc.
Eighny Four. Pa (США) или
пробоотборник с аналогичными
характеристиками
Действие на вредные организмы
Механизм действия. Диметиламинная соль 2-метил-4-хлоруксусной кислоты (МЦПА) по свойствам и характеру действия на растения близка к 2,4-Д, но более избирательна и менее токсична для культур. Является системным послевсходовым гербицидом. Быстро поглощается корнями и листьями, действует на наземные органы растения и корни. Действующее вещество действует на сорняк многообразно, нарушая гормональный баланс, препятствуя синтезу белков, вызывая аномалии в росте и развитии. В тканях растения происходит неконтролируемое деление клеток, что приводит к диспропорции между водным балансом, ассимиляцией и нормальным ростом. В итоге наступает гибель растения от истощения.
Эффект от применения гербицида наблюдается спустя 2-7 суток. Пластинки и черешки листьев искривляются и разрастаются, стебли изгибаются, у листьев изменяется окраска.
Синтез
Традиционным методом синтеза иминов является конденсация альдегидов и кетонов с первичными аминами. На первой стадии происходит нуклеофильная атака аминогруппы по электрофильному карбонильному атому углерода с образованием неустойчивого гем-аминоспирта, который далее дегидратируется до имина:
В случае альдегидов, несущих сильные электронакцепторные заместители при альдегидной группе (хлораль, гексафторацетон и т. п.), образуются стабильные гем-аминоспирты.
Имины также могут быть синтезированы окислением вторичных аминов надкислотами:
- R2CH-NHR1 + →{\displaystyle \to } R2C=NR1 + H2O
или через образование N-хлораминов с дальнейшим отщеплением от них хлороводорода:
- R2CH-NClR1 + OH−→{\displaystyle \to } R2C=NR1 + H2O + Cl−
Специфическим методом синтеза α-оксоиминов является термическое разложение в инертном растворителе α-азидокетонов, получаемых взаимодействием α-галогенкетонов с азидом натрия:
- RCOCH2Hal + NaN3→{\displaystyle \to } RCOCH2N3 + NaHal
- RCOCH2N3→{\displaystyle \to } RCOCH=NH + N2
Аналогичным образом происходит разложение функционализированных α-азидокетонов под действием аминов, в этом случае реакция сопровождается конденсацией амина с карбонильным фрагментом, что ведет к образованию 1,2-дииминов, таутомеризующихся далее в γ-имино-β-енамины:
- RCOCH(N3)CH2COOEt + R’NH2→{\displaystyle \to } RC(=NR’)C(=NH)CH2COOEt
- RC(=NR’)C(=NH)CH2COOEt →{\displaystyle \to } RC(=NR’)C(NH2)=CHCOOEt
Реакционная способность
Атом азота в иминах слабонуклеофилен, атом углерода — электрофилен.
Имины обладают слабоосновными свойствами и в отсутствие воды могут протонироваться и алкилироваться по атому азота с образованием иминиевых солей:
- R2C=NR1 + R2Hal →{\displaystyle \to } R2C=N+R1R2•Hal−
Иминиевые соли также образуются при алкилировании и ацилировании иминов, продукты алкилирования могут быть выделены, в случае ацилирования промежуточно образующиеся ацилиминиевые соли циклизуются в β-лактамы (азетидин-2-оны)
Реакции иминов с нуклеофилами протекают по атому углерода, весьма разнообразны и широко используются в органическом синтезе.
Так, имины гидролизуются водой с образованием карбонильных соединений и аминов, эта реакция обратна реакции синтеза иминов:
- R2C=NR1 + H2O →{\displaystyle \to } R2C=O + R1NH2
Реакции иминов с аминами приводят к образованию аминалей (гем-диаминов):
- R2C=NR1 + R1NH2→{\displaystyle \to } R2C(NR1)2
Реакция иминов с цианистым водородом либо триметилсилилцианидом является вариантом реакции Штреккера и, в случае N-замещенных иминов, может служить методом синтеза N-замещенных α-аминокислот:
- R2C=NR1 + HCN →{\displaystyle \to } R2C(NHR1)CN
- R2C(NHR1)CN + 2H2O →{\displaystyle \to } R2C(NHR1)COOH + NH3
Взаимодействие реактивов Гриньяра и литийорганических соединений с иминами ведет к C-алкилированию последних с образованием аминов:
- R2C=NR1 + R2Li →{\displaystyle \to } R2R2CN− R1 Li+
- R2R2CN− R1 Li+ + H2O →{\displaystyle \to } R2R2CNHR1 + LiOH
Имины вступают в различные реакции циклоприсоединения, образуя с карбенами продукты (2+1)-циклоприсоединения — азиридины, с кетенами идет (2+2)-циклоприсоединение с образованием азетидин-2-оны (синтез β-лактамов по Штаудингеру, формально — ацилирования иминов кетенами):
С 1,3-диполярными соединениями (диазометаном, нитрилоксидами) образуются пятичленные гетероциклы — продукты (2+3)-циклоприсоединения.
Имины также могут выступать в роли диенофилов в реакции Дильса-Альдера:
Под действием энергичных восстановителей (алюмогидрид лития, борогидрид натрия, водород над никелем Ренея и т. п.) имины восстанавливаются до вторичных аминов:
- R2C=NR1 + →{\displaystyle \to } R2CH-NHR1
Имины, образованные из енолизирующихся карбонильных соединений, способны к имин-енаминной таутомерии:
Общие особенности строения аминов
Также как и в молекуле аммиака, в молекуле любого амина атом азота имеет неподеленную электронную пару, направленную в одну из вершин искаженного тетраэдра:
По этой причине у аминов как и у аммиака существенно выражены основные свойства.
Так, амины аналогично аммиаку обратимо реагируют с водой, образуя слабые основания:
Связь катиона водорода с атомом азота в молекуле амина реализуется с помощью донорно-акцепторного механизма за счет неподеленной электронной пары атома азота. Предельные амины являются более сильными основаниями по сравнению с аммиаком, т.к. в таких аминах углеводородные заместители обладают положительным индуктивным (+I) эффектом. В связи с этим на атоме азота увеличивается электронная плотность, что облегчает его взаимодействие с катионом Н+.
Ароматические амины, в случае если аминогруппа непосредственно соединена с ароматическим ядром, проявляют более слабые основные свойства по сравнению с аммиаком. Связано это с тем, что неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца в следствие чего, электронная плотность на атоме азота снижается. В свою очередь это приводит к снижению основных свойств, в частности способности взаимодействовать с водой. Так, например, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Химические свойства анилина
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
I. Основные свойства
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин более слабое основание, чем предельные амины и аммиак.
Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида, а его водный раствор не окрашивает лакмус в синий цвет.
Анилин с водой не реагирует и не изменяет окраску индикатора!!!
Видеоопыт «Изучение среды раствора анилина»
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
II. Особые свойства анилина
Реакции с участием аминогруппы
1. Взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но не растворимы в неполярных органических растворителях:
Видеоопыт «Взаимодействие анилина с соляной кислотой»
Анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин снова выделится в свободном виде:
Реакции с участием бензольного ядра
Аминогруппа как заместитель I рода облегчает реакции замещения в бензольном ядре, при этом заместители становятся в орто- и пара-положения к аминогруппе.
При бромировании анилин легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине анилин легко окисляется.
1. Галогенирование
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина. Эта реакция может использоваться для качественного и количественного определения анилина:
Качественная реакция на анилин!
Видеоопыт «Бромирование анилина»
2. Сульфирование
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
III. Окисление анилина
Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении.
При действии хлорной извести Ca (Cl) OCl на водный раствор анилина появляется интенсивное фиолетовое окрашивание.
Качественная реакция на анилин!
Видеоопыт «Окисление анилина раствором хлорной извести – качественная реакция»
При взаимодействии анилина с хромовой известью (смесь концентрированной серной кислоты и дихромата калия К2Cr2O7) образуется черный осадок, называемый черным анилином (краситель «анилиновый черный»).
Черный анилин применяется как прочный краситель (для окраски тканей и меха в черный цвет). Обычно ткань сначала пропитывают раствором окислителя. Образующийся черный анилин откладывается в порах волокна. Он не растворим в воде и устойчив к мылу и свету.
Видеоопыт «Окисление анилина раствором дихроматом калия – получение красителей»
IV. Диазотирование анилина
Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
Рубрики: Амины Теги: Амины
Синтез
Традиционным методом синтеза иминов является конденсация альдегидов и кетонов с первичными аминами. На первой стадии происходит нуклеофильная атака аминогруппы по электрофильному карбонильному атому углерода с образованием неустойчивого гем-аминоспирта, который далее дегидратируется до имина:
В случае альдегидов, несущих сильные электронакцепторные заместители при альдегидной группе (хлораль, гексафторацетон и т. п.), образуются стабильные гем-аминоспирты.
Имины также могут быть синтезированы окислением вторичных аминов надкислотами:
- R2CH-NHR1 + →{\displaystyle \to } R2C=NR1 + H2O
или через образование N-хлораминов с дальнейшим отщеплением от них хлороводорода:
- R2CH-NClR1 + OH−→{\displaystyle \to } R2C=NR1 + H2O + Cl−
Специфическим методом синтеза α-оксоиминов является термическое разложение в инертном растворителе α-азидокетонов, получаемых взаимодействием α-галогенкетонов с азидом натрия:
- RCOCH2Hal + NaN3→{\displaystyle \to } RCOCH2N3 + NaHal
- RCOCH2N3→{\displaystyle \to } RCOCH=NH + N2
Аналогичным образом происходит разложение функционализированных α-азидокетонов под действием аминов, в этом случае реакция сопровождается конденсацией амина с карбонильным фрагментом, что ведет к образованию 1,2-дииминов, таутомеризующихся далее в γ-имино-β-енамины:
- RCOCH(N3)CH2COOEt + R’NH2→{\displaystyle \to } RC(=NR’)C(=NH)CH2COOEt
- RC(=NR’)C(=NH)CH2COOEt →{\displaystyle \to } RC(=NR’)C(NH2)=CHCOOEt