Оксид стронция (sro) свойства, применение и риски
Содержание:
СТРОНЦИЙ ИСТОРИЯ ОТКРЫТИЯ ЭЛЕМЕНТА
Еще задолго до открытия стронция его не расшифрованные соединения применяли в пиротехнике для получения красных огней. И до середины 40-х годов нашего века стронций был прежде всего металлом фейерверков, потех и салютов. Атомный век заставил взглянуть на него по-иному. Во-первых, как на серьезную угрозу всему живому на Земле; во-вторых, как на материал, могущий быть очень полезным при решении серьезных проблем медицины и техники. Но об атом позже, а начнем с истории «потешного» металла, с истории, в которой встречаются имена многих больших ученых.
Четырежды открытый стронций
В 1764 г. в свинцовом руднике близ шотландской деревни Стронциан был найден минерал, который назвали стронцианитом. Долгое время его считали разновидностью флюорита CaF2 или витерита ВаСО3, но в 1790 г. английские минералоги Кроуфорд и Крюикшенк проанализировали этот минерал и установили, что в нем содержится новая «земля», а говоря нынешним языком, окисел.
Независимо от них тот же минерал изучал другой английский химик — Хоп. Придя к таким же результатам, он объявил, что в стронцианите есть новый элемент — металл стронций. Видимо, открытие уже «витало в воздухе», потому что почти одновременно сообщил об обнаружении новой «земли» и видный немецкий химик Клапрот.
В те же годы на следы «стронциановой земли» натолкнулся и известный русский химик — академик Товий Егорович Ловиц. Его издавна интересовал минерал, известный под названием тяжелого шпата. В этом минерале (его состав BaSО4) Карл Шееле открыл в 1774 г. окись нового элемента бария. Не знаем, отчего Ловиц был неравнодушен именно к тяжелому шпату; известно только, что ученый, открывший адсорбционные свойства угля и сделавший еще много в области общей и органической химии, коллекционировал образцы этого минерала. Но Ловиц не был просто собирателем, вскоре он начал систематически исследовать тяжелый шпат и в 1792 г. пришел к выводу, что в этом минерале содержится неизвестная примесь.
Он сумел извлечь из своей коллекции довольно много — больше 100 г новой «земли» и продолжал исследовать ее свойства. Результаты исследования были опубликованы в 1795 г. Ловиц писал тогда: «Я был приятно поражен, когда прочел… прекрасную статью г-на профессора Клапрота о стронциановой земле, о которой до этого имелось очень неясное представление… Все указанные им свойства солекислых и селитрокислых средних солей во всех пунктах совершеннейшим образом совпадают со свойствами моих таких же солей… Мне оставалось только проверить… замечательное свойство стронциановой земли — окрашивать спиртовое пламя в карминово-красный цвет, и, действительно, моя соль… обладала в полной мере этим свойством».
Так почти одновременно несколько исследователей в разных странах вплотную подошли к открытию стронция. Но в элементном виде его выделили лишь в 1808 г.
Выдающийся ученый своего времени Хэмфри Дэви понимал уже, что элемент стронциановой земли должен быть, по-видимому, щелочноземельным металлом, и получил его электролизом, т. е. тем же способом, что и кальций, магний, барий. А если говорить конкретнее, то первый в мире металлический стронций был получен при электролизе его увлажненной гидроокиси. Выделявшийся на катоде стронций мгновенно соединялся с ртутью, образуя амальгаму. Разложив амальгаму нагреванием, Дэви выделил чистый металл.
Металл этот белого цвета, не тяжелый (плотность 2,6 г/см3), довольно мягкий, плавящийся при 770° С. По химическим свойствам он типичный представитель семейства щелочноземельных металлов. Сходство с кальцием, магнием, барием настолько велико, что в монографиях и учебниках индивидуальные свойства стронция, как правило, не рассматриваются— их разбирают на примере кальция или магния.
И в области практических применений эти металлы не раз заступали дорогу стронцию, потому что они более доступны и дешевы. Так произошло, например, в сахарном производстве. Когда-то один химик обнаружил, что с помощью дисахарата стронция (C12H22О4 • 2SrO), нерастворимого в воде, можно выделять сахар из мелассы
Внимание к стронцию сразу же возросло, получать его стали больше, особенно в Германии и Англии. Но скоро другой химик нашел, что аналогичный сахарат кальция тоже нерастворим
И интерес к стронцию тут же пропал. Выгоднее ведь использовать дешевый, чаще встречающийся кальций.
Статья на тему Стронций история
свойства
Гидроксид бериллия имеет молярную массу или приблизительную молекулярную массу 43,0268 г / моль и плотность 1,92 г / см.3. Его температура плавления находится при температуре 1000 ° С, при которой начинается его разложение..
В качестве минерала, Be (OH)2 (Behoita) имеет твердость 4, а его плотность составляет 1,91 г / см.3 и 1,93 г / см3.
внешний вид
Гидроксид бериллия представляет собой белое твердое вещество, которое в своей альфа-форме имеет желатиновый и аморфный вид. С другой стороны, бета-форма этого соединения имеет четко выраженную орторомбическую и стабильную кристаллическую структуру..
Можно сказать, что морфология минерала Be (OH)2 он разнообразен, потому что его можно найти в виде ретикулярных кристаллов, древесных или сферических агрегатов. Точно так же это прибывает в белый, розовый, голубоватый и даже бесцветный и с жирным стекловидным блеском.
Термохимические свойства
Энтальпия образования: -902,5 кДж / моль
Энергия Гиббса: -815,0 кДж / моль
Энтропия образования: 45,5 Дж / моль
Теплоемкость: 62,1 Дж / моль
Удельная теплоемкость: 1443 Дж / К
Стандартная энтальпия образования: -20,98 кДж / г
растворимость
Гидроксид бериллия по своей природе амфотерный, поэтому он способен отдавать или принимать протоны и растворять как кислые, так и щелочные среды в кислотно-щелочной реакции с образованием соли и воды..
В этом смысле растворимость Be (OH)2 в воде ограничен продуктом растворимости Kps(H 2 O), что равно 6,92 × 10-22.
Риски подверженности
Законно допустимый предел воздействия на человека (PEL или OSHA) вещества, содержащего гидроксид бериллия, установлен для максимальной концентрации от 0,002 мг / м.3 и 0,005 мг / м3 составляет 8 часов, а для концентрации 0,0225 мг / м3 максимум 30 минут.
Эти ограничения связаны с тем, что бериллий классифицируется как канцерогенный агент типа А1 (канцерогенный агент у людей, на основании количества данных эпидемиологических исследований).
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних солей:
<.p>
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Например:
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.
Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000oC:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 oC:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
Применение стронция-90.
Радиоизотоп стронция применяется в производстве атомных электрических батарей. Принцип действия таких батарей основан на способности стронция-90 излучать электроны, обладающие большой энергией, преобразуемой затем в электрическую. Элементы из радиоактивного стронция, соединенные в миниатюрную батарейку (размером со спичечную коробку), способны безотказно служить без перезарядки 15–25 лет, такие батареи незаменимы для космических ракет и искусственных спутников Земли. А швейцарские часовщики с успехом используют крохотные стронциевые батарейки для питания электрочасов.
Отечественными учеными создан изотопный генератор электрической энергии для питания автоматических метеостанций на основе стронция-90. Гарантийный срок службы такого генератора – 10 лет, в течение которых он способен снабжать электрическим током нуждающиеся в нем приборы. Все обслуживание его заключается лишь в профилактических осмотрах – раз в два года. Первые образцы генератора установлены в Забайкалье и в верховьях таежной речки Кручины.
В Таллинне работает атомный маяк. Главная его особенность – радиоизотопные термоэлектрические генераторы, в которых в результате распада стронция-90 возникает тепловая энергия, преобразуемая затем в световую.
Устройства, в которых используется радиоактивный стронций, применяются для измерения толщины. Это необходимо для контроля и управления процессом производства бумаги, тканей, тонких металлических лент, пластмассовых пленок, лакокрасочных покрытий. Изотоп стронция используется в приборах для измерения плотности, вязкости и других характеристик вещества, в дефектоскопах, дозиметрах, сигнализаторах. На машиностроительных предприятиях часто можно встретить так называемые b-реле, они контролируют подачу заготовок на обработку, проверяют исправности инструмента, правильность положения детали.
При производстве материалов, являющихся изоляторами (бумага, ткани, искусственное волокно, пластмассы и т. д.), вследствие трения возникает статическое электричество. Чтобы избежать этого, пользуются ионизирующими стронциевыми источниками.
Елена Савинкина
Тип ссылки
Химическая формула оксида стронция — SrO, но она не объясняет абсолютно химическую структуру или тип существующей связи.
В предыдущем разделе было упомянуто, что оно имеет подобную драгоценным камням структуру; то есть кристаллическая структура, очень распространенная для многих солей.
Следовательно, тип связи преимущественно ионный, что объясняет, почему этот оксид имеет высокие температуры плавления и кипения..
Поскольку связь является ионной, именно электростатические взаимодействия удерживают атомы стронция и кислорода вместе: Sr2 + O2-.
Если бы эта связь была ковалентной, соединение могло бы быть представлено связями в его структуре Льюиса (исключая неразделенные электронные пары кислорода).
Характеристика элемента
Название этого элемента ассоциируется с радиоактивной опасностью, так как близость свойств кальция и стронция позволяют Sr активно участвовать в обмене веществ и вместе с кальцием откладываться в костной ткани. Опасность, однако, представляет не природный стронций, состоящий из смеси четырех изотопов 84, 86, 87 и 88, а искусственно получаемые радио-активные изотопы этого элемента. Особенно 90Sr, образующейся в результате цепной ядерной реакции. Период его полураспада 27,7 года, он р-излучатель и потоки его электронов активно воздействуют на живую ткань организма. Соединения же не радиоактивного стронция совершенно безвредны (как и кальция) для человека и животных. Для растений они ядовиты.
По своим характеристикам стронций занимает промежуточное положение между кальцием и барием. Его первый и второй потенциалы ионизации невелики и составляют соответственно 5,7 и 11,03 эВ. Для него известно существование только иона Sr2+. Хотя для образования такого иона требуется в два раза больше энергии, чем для Sr+, она компенсируется за счет энергии образования ионных соединений. Ион Sr2+ исключительно стабилен, так как имеет электронную оболочку инертного газа.
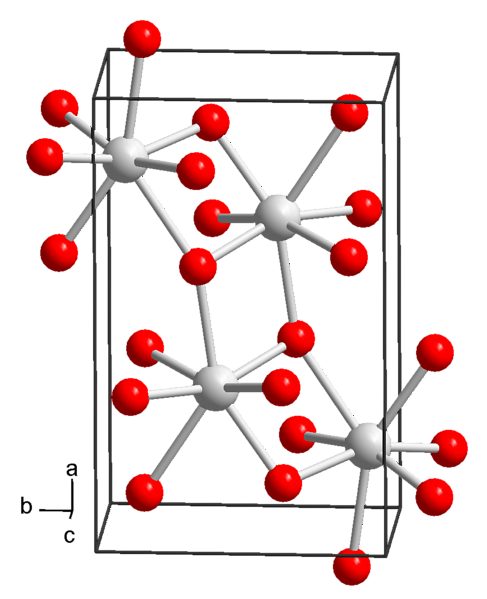
Химическая структура и физико-химические свойства
В настоящее время известны 3 формы гидроксида стронция: октагидрат, моногидрат и безводный..
Октагидрат гидроксида стронция
Из растворов при нормальных условиях температуры и давления (25 ° C и 1 атм) гидроксид стронция осаждается в октагидратированной форме, химическая формула которой Sr (OH)2H 8H2О.
Это соединение имеет молярную массу 265,76 г / моль, плотность 1,90 г / см и осаждается в виде тетрагональных кристаллов (с пространственной группой P4 / ncc) четырехугольного и бесцветного призматического вида..
Кроме того, октагидрат гидроксида стронция обладает способностью поглощать атмосферную влагу, так как является легко растекающимся соединением..
Моногидрат гидроксида стронция
По данным оптических микроскопических исследований (выполненных с использованием техники дифракции рентгеновских лучей), путем повышения температуры примерно до 210 ° С — при постоянном атмосферном давлении — Sr (OH)2H 8H2Или он обезвоживается и превращается в моногидрат гидроксида стронция (Sr (OH)2∙ H2O).
Эта форма соединения имеет молярную массу 139,65 г / моль, а его температура плавления составляет -73,15 ° С (375 К). Из-за своей атомной конфигурации он обладает более низкой растворимостью в воде, чем описано в октагидратированной форме..
Безводный гидроксид стронция
Продолжая повышать температуру системы до примерно 480 ° С, дегидратацию продолжают до тех пор, пока не будет получен безводный гидроксид стронция..
В отличие от его гидратированных форм, он имеет молярную массу 121,63 г / моль и плотность 3,625 г / см.3. Его температура кипения достигается при 710 ° C (1310 ° F или 983 K), в то время как температура плавления составляет 535 ° C (995 ° F или 808 K)..
растворимость
Октагидратированный гидроксид стронция имеет растворимость в воде 0,91 грамма на 100 миллилитров (измерено при 0 ° C), в то время как его безводная форма при аналогичных температурных условиях имеет растворимость 0,41 грамма на 100 миллилитров..
Таким же образом, это вещество считается нерастворимым в ацетоне и полностью растворимым в кислотах и хлориде аммония..
Химическая реактивность
Гидроксид стронция не горюч, его химическая реакционная способность остается стабильной при умеренных температурах и давлениях и способен поглощать диоксид углерода из атмосферного воздуха, превращая его в карбонат стронция..
Кроме того, это сильно раздражающее соединение, если оно вступает в контакт с кожей, дыхательными путями или другими слизистыми оболочками тела..
Важнейшие соединения:
Оксид стронция представляет собой белое тугоплавкое вещество, энергично присоединяющее воду с образованием белого гидроксида. Наряду с оксидом известен белый пероксид стронция(II)Гидроксид стронция, Sr(OH)2 — сильное основание, хорошо растворимое в воде. При взаимодействии с кислотами оксид и гидроксид легко образуют соли, как правило, бесцветные.Нитрат стронция, Sr(NO3)2 выделяется в виде кристаллогидратов, которые очень легко растворимы в воде. Нитратам аналогичны по составу хлораты, броматы, иодаты. Растворимость солей в воде уменьшается в ряду: Ca — Sr — Ba и Cl — Br — I. Сульфид стронция представляет собой твердое белое вещество. Известны полисульфиды стронция SrSn.
ссылки
- Американские элементы. (1998-2018). Американские элементы. Получено 14 марта 2018 года с сайта American Elements: americanelements.com
- AllReactions. Получено 14 марта 2018 года от AllReactions: allreactions.com
- Дрожь и Аткинс. (2008). Неорганическая химия В структурах простых тел (Четвертое изд., Стр. 84). Mc Graw Hill.
- ATSDR. Получено 14 марта 2018 года из ATSDR: atsdr.cdc.gov
- Кларк Дж. (2009). chemguide. Получено 14 марта 2018 г. из chemguide: chemguide.co.uk
- Tiwary, R., Narayan, S. & Pandey, O. (2007). Получение оксида стронция из целестита: обзор. Материаловедение, 201-211.
- Chegg Inc. (2003-2018). Чегг Этюд. Получено 16 марта 2018 г. от Chegg Study: chegg.com
Молярная масса элементов и соединений
Соединения — вещества, состоящие из различных атомов, которые химически связаны друг с другом. Например, приведенные ниже вещества, которые можно найти на кухне у любой хозяйки, являются химическими соединениями:
- соль (хлорид натрия) NaCl
- сахар (сахароза) C₁₂H₂₂O₁₁
- уксус (раствор уксусной кислоты) CH₃COOH
Молярная масса химических элементов в граммах на моль численно совпадает с массой атомов элемента, выраженных в атомных единицах массы (или дальтонах). Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении. Например, молярная масса воды (H₂O) приблизительно равна 1 × 2 + 16 = 18 г/моль.
Примечания
- ↑
- Greenwood and Earnshaw, p. 111
- Редкол.: Зефиров Н. С. (гл. ред.). Химическая энциклопедия: в 5 т. — М.: Большая Российская энциклопедия, 1995. — Т. 4. — С. 441. — 639 с. — 20 000 экз. — ISBN 5—85270—092—4.
- . geokhi.ru. Дата обращения 11 мая 2016.
- J.P. Riley and Skirrow G. Chemical Oceanography V. I, 1965
- А. М. Портнов. . Независимая газета (28 сентября 2011).
- ↑ Greenwood and Earnshaw, pp. 112-13
- ↑ C. R. Hammond The elements (pp. 4-35) in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ . U.S. Geological Survey (8 декабря 2014). Дата обращения 16 августа 2015.
- ↑ (недоступная ссылка). Дата обращения 15 марта 2009.
Гидроксид — стронций
Гидроксиды стронция и бария Sr ( OH) 2 и Ва ( ОН) 2 представляют собой сильные основания, лучше растворимые в воде, чем гидроксид кальция: один литр воды при 20 С растворяет 8 г гидроксида стронция и 38 г гидроксида бария. Насыщенный раствор гидроксида бария называется баритовой водой и часто применяется в качестве реактива.
Гидроксиды стронция и бария Sr ( OH) 2 и Ва ( ОН) 2 представляют собой сильные основания, лучше растворимые в воде, чем гидроксид кальция: один литр воды при 20 С растворяет 8 г гидрокснда стронция и 38 г гидроксида бария. Насыщенный раствор гидроксида бария называется баритовой водой и часто применяется в качестве реактива.
Гидроксиды стронция и бария Sr ( OH) a и Ва ( ОН) г представляют собой сильные основания, лучше растворимые в воде, чем гидроксид кальция: один литр воды при 20 С растворяет 8 г гидроксида стронция и 38 г гидроксида бария. Насыщенный раствор гидроксида бария называется баритовой водой и часто применяется в качестве реактива.
Гидроксиды стронция и кальция являются довольно сильными, относительно хорошо растворимыми основаниями.
Гидроксиды стронция и бария Sr ( OH) j и Ва ( ОН) г представляют собой сильные основания, лучше растворимые в воде, чем гидроксид кальция: один литр воды при 20 С растворяет 8 г гидроксида стронция и 38 г гидроксида бария. Насыщенный раствор гидроксида бария называется баритовой водой и часдо применяется в качестве реактива.
Гидроксиды стронция и бария Sr ( OH) 2 и Ва ( ОН) 2 представляют собой сильные основания, лучше растворимые в воде, чем гидроксид кальция: один литр воды при 20 С растворяет 8 г гидроксида стронция и 38 г гидроксида бария. Насыщенный раствор гидроксида бария называется баритовой водой и часто применяется в качестве реактива.
Гидроксиды стронция и бария Sr ( QH) 2 и Ва ( ОН) 2 представляют собой сильные основания, лучше растворимые в воде, чем гидроксид кальция: один литр воды при 20 С растворяет 8 г гидроксида стронция и 38 г гидроксида бария. Насыщенный раствор гидроксида бария называется баритовой водой и часто применяется в качестве реактива.
Гидроксид стронция растворяется еще лучше, раствор его является сильным основанием.
|
Физические константы, теплоты образования и растворения фторидов. |
Гидроксид стронция в настоящее время находит себе применение в сахароварении в качестве заменителя Са ( ОН) 2, так как он дает сахарат стронция C12H22OU 2SrO, менее растворимый, нежели сахарат кальция. Является исходным веществом для получения других соединений стронция.
Гидроксиды стронция и бария Sr ( OH) 2 и Ва ( ОН) 2 представляют собой сильные основания, лучше растворимые в воде, чем гидроксид кальция: один литр воды при 20 СС растворяет 8 г гидрокспда стронция ц 38 г гидрокснда бария. Насыщенный раствор гидроксида бария называется баритовой водой и часто применяется в качестве реактива.
Гидроксиды стронция и бария Sr ( OH) 2 и Ва ( ОН) 2 представляют собой сильные основания, лучше растворимые в воде, чем гидроксид кальция: один литр воды при 20 С растворяет 8 г гидроксида стронция и 38 г гидроксида бария. Насыщенный раствор гидроксида бария называется баритовой водой и часто применяется в качестве реактива.
Гидроксиды стронция и-бария Sr ( OH) 2 и Ва ( ОН) 2 представляют собой сильные основания, лучше растворимые в воде, чем гидроксид кальция: один литр воды при 20 С растворяет 8 г гидроксида стронция и 38 г гидроксида бария. Насыщенный раствор гидроксида бария называется баритовой водой и часто применяется в качестве реактива.
Выпавший осадок гидроксида стронция быстро отсасывают на воронке с пористой стеклянной пластинкой, промывают прокипяченной и Голодной водой и сушат при 80 — 100 С. Получающийся гидроксид стронция представляет собой прозрачные мелкие кристаллы, быстро тускнеющие на воздухе вследствие образования карбоната стронция. Хранить его нужно в плотно закрытой склянке.
Выпавший осадок гидроксида стронция быстро отсасывают на воронке с пористой стеклянной пластинкой, промывают прокипяченной и холодной водой и сушат при 80 — 100 С. Получающийся гидроксид стронция представляет собой прозрачные мелкие кристаллы, быстро тускнеющие на воздухе вследствие образования карбоната стронция. Хранить его нужно в плотно закрытой склянке.
Характеристика простого вещества и промышленное получение металлического стронция.
Металлический стронций имеет серебристо-белую окраску. В неочищенном состоянии он окрашен в бледно-желтый цвет. Это сравнительно мягкий металл, легко режется ножом. При комнатной температуре стронций имеет кубическую гранецентрированную решетку (a-Sr); при температуре выше 231° С превращается в гексагональную модификацию (b-Sr); при 623° С переходит в кубическую объёмноцентрированную модификацию (g-Sr). Стронций относится к легким металлам, плотность его a-формы 2,63г/см3 (20° С). Температура плавления стронция равна 768° С, температура кипения составляет 1390° С.
Являясь щелочноземельным металлом, стронций активно реагирует с неметаллами. При комнатной температуре металлический стронций покрывается пленкой из оксида и пероксида. При нагревании на воздухе воспламеняется. Стронций легко образует нитрид, гидрид и карбид. При повышенных температурах стронций реагирует с диоксидом углерода:
5Sr + 2CO2 = SrC2 + 4SrO
Металлический стронций взаимодействует с водой и кислотами, выделяя из них водород:
Sr + 2H3O+ = Sr2+ + H2 + 2H2O
Реакция не идет в тех случаях, когда образуются малорастворимые соли.
Стронций растворяется в жидком аммиаке с образованием темно-синих растворов, из которых при выпаривании можно получить блестящий аммиакат медного цвета Sr(NH3)6, постепенно разлагающийся до амида Sr(NH2)2.
Для получения металлического стронция из природного сырья целестиновый концентрат сначала восстанавливают при нагревании углем до сульфида стронция. Затем сульфид стронция обрабатывают соляной кислотой, а полученный хлорид стронция обезвоживают. Стронцианитовый концентрат разлагают обжигом при 1200° С, а затем растворяют образовавшийся оксид стронция в воде или кислотах. Нередко стронцианит сразу растворяют в азотной или соляной кислоте.
Металлический стронций получают электролизом смеси расплавленных хлорида стронция (85%) и хлорида калия или аммония (15%) на никелевом или железном катоде при 800° С. Полученный этим методом стронций обычно содержит 0,3–0,4% калия.
Используют также высокотемпературное восстановление оксида стронция алюминием:
4SrO + 2Al = 3Sr + SrO·Al2O3
Для металлотермического восстановления оксида стронция применяют также кремний или ферросилиций. Процесс ведут при 1000° С в вакууме в стальной трубке. Хлорид стронция восстанавливают металлическим магнием в атмосфере водорода.
Крупнейшими производителями стронция являются Мексика, Испания, Турция и Великобритания.
Несмотря на довольно большое содержание в земной коре, широкого применения металлический стронций еще не нашел. Как и другие щелочноземельные металлы, он способен очищать черный металл от вредных газов и примесей. Это свойство дает стронцию перспективу применения в металлургии. Кроме того, стронций является легирующей добавкой к сплавам магния, алюминия, свинца, никеля и меди.
Металлический стронций поглощает многие газы и поэтому используется в качестве геттера в электровакуумной технике.
Молекулярная масса

Молекулярная масса (старое название — молекулярный вес) — это масса молекулы, рассчитанная как сумма масс каждого атома, входящего в состав молекулы, умноженных на количество атомов в этой молекуле. Молекулярная масса представляет собой безразмерную физическую величину, численно равную молярной массе. То есть, молекулярная масса отличается от молярной массы размерностью. Несмотря на то, что молекулярная масса является безразмерной величиной, она все же имеет величину, называемую атомной единицей массы (а.е.м.) или дальтоном (Да), и приблизительно равную массе одного протона или нейтрона. Атомная единица массы также численно равна 1 г/моль.
Свойства простого вещества и соединений
Оксид стронция SrO — бесцветные кристаллы, жадно присоединяющие воду с образованием основания Sr(OH)2. Стронцианит — Sr[СО3]. Назван по месту нахождения вблизи с. Строншен в Шотландии, где впервые был обнаружен
Гидроксид стронция— более сильное основание, чем Са(ОН)2. На воздухе расплавляется, так как поглощает воду. Если через водный раствор пропускать СO2, то образуется осадок карбоната стронция :
Sr(ОН)2 + СO2 = SrCO3 + Н2O
Растворимость солей стронция обычно выше, чем бария, но ниже, чем растворимость солей кальция. Хорошо растворимы галогениды (кроме SrF2), нитрат, ацетат, хлорат. Сульфат стронция лучше растворим, чем BaSO4, но хуже, чем CaSO4.
Биологическая роль стронция.
Стронций – составная часть микроорганизмов, растений и животных. У морских радиолярий скелет состоит из сульфата стронция – целестина. Морские водоросли содержат 26–140 мг стронция на 100 г сухого вещества, наземные растения – около 2,6, морские животные – 2–50, наземные животные – около 1,4, бактерии – 0,27–30. Накопление стронция различными организмами зависит не только от их вида, особенностей, но и от соотношения содержания стронция и других элементов, главным образом кальция и фосфора, в окружающей среде.
Животные получают стронций с водой и пищей. Некоторые вещества, например полисахариды водорослей, препятствует усвоению стронция. Стронций накапливается в костной ткани, в золе которой содержится около 0,02% стронция (в других тканях – около 0,0005%).
Соли и соединения стронция относятся к малотоксичным веществам, однако при избытке стронция поражаются костная ткань, печень и мозг. Будучи близок к кальцию по химическим свойствам, стронций резко отличается от него по своему биологическому действию. Избыточное содержание этого элемента в почвах, водах и продуктах питания вызывает «уровскую болезнь» у человека и животных (по названию реки Уров в Восточном Забайкалье) – поражение и деформацию суставов, задержку роста и другие нарушения.
Особенно опасны радиоактивные изотопы стронция.
В результате ядерных испытаний и аварий на АЭС в окружающую среду поступило большое количество радиоактивного стронция-90, период полураспада которого составляет 29,12 года. До тех пор, пока не были запрещены испытания атомного и водородного оружия в трех средах, число пострадавших от радиоактивного стронция росло из года в год.
В течение года после завершения атмосферных ядерных взрывов в результате самоочищения атмосферы большая часть радиоактивных продуктов, в том числе стронция-90, выпала из атмосферы на поверхность земли. Загрязнение природной среды за счет выведения из стратосферы радиоактивных продуктов ядерных взрывов, проводившихся на полигонах планеты в 1954–1980, сейчас играет второстепенную роль, вклад этого процесса в загрязнение атмосферного воздуха 90Sr на два порядка меньше, чем от ветрового подъема пыли с почвы, загрязненной при ядерных испытаниях и в результате радиационных аварий.
Стронций-90, наряду с цезием-137, являются основными загрязняющими радионуклидами на территории России. На радиационную обстановку существенно влияет наличие загрязненных зон, появившихся вследствие аварий на Чернобыльской АЭС в 1986 и на ПО «Маяк» в Челябинской области в 1957 («Кыштымская авария»), а также в окрестностях некоторых предприятий ядерно-топливного цикла.
Сейчас время средние концентрации 90Sr в воздухе за пределами территорий, загрязненных в результате Чернобыльской и Кыштымской аварий, вышли на уровни, наблюдавшиеся до аварии на Чернобыльской АЭС. В гидрологических системах, связанных с зонами, загрязненными при этих авариях, существенно сказывается смыв стронция-90 с поверхности почвы.
Попадая в почву, стронций вместе с растворимыми соединениями кальция поступает в растения. Больше других накапливают 90Sr бобовые растения, корне- и клубнеплоды, меньше – злаки, в том числе зерновые, и лён. В семенах и плодах накапливается значительно меньше 90Sr, чем в других органах (например, в листьях и стеблях пшеницы 90Sr в 10 раз больше, чем в зерне).
Из растений стронций-90 может непосредственно или через животных перейти в организм человека. У мужчин стронций-90 накапливается в большей степени, чем у женщин. В первые месяцы жизни ребенка отложение стронция-90 на порядок выше, чем у взрослого человека, он поступает в организм с молоком и накапливается в быстро растущей костной ткани.
Радиоактивный стронций сосредотачивается в скелете и, таким образом, подвергает организм длительному радиоактивному воздействию. Биологическое действие 90Sr связано с характером его распределения в организме и зависит от дозы b-облучения, создаваемого им и его дочерним радиоизотопом 90Y. При длительном поступлении 90Sr в организм даже в относительно небольших количествах, в результате непрерывного облучения костной ткани, могут развиваться лейкемия и рак костей. Полный распад стронция-90, попавшего в окружающую среду, произойдет лишь через несколько сотен лет.