Определение углеводороды
Содержание:
Где находятся углеводороды?
Основным источником углеводородов является нефть. Из-за этого углеводород присутствует в различных производных, таких как керосин, парафин, природный газ, бензин, вазелин, дизельное топливо, LPG (сжиженный нефтяной газ), полимеры (такие как пластик и резина) и другие.
Это органическое соединение составляет 48% энергетической матрицы Бразилии.
Углеродная цепь, которая является частью композиции углеводорода, является четырехвалентной, то есть она может образовывать четыре связи.
Углерод способен связываться с другими атомами углерода и с атомами водорода через одинарные, двойные или тройные связи .
Спирты и фенолы
Спирты – производные углеводородов, один или несколько атомов водорода в которых заменены на гидроксильную группу -OH. Спирты с одной гидроксильной группой называют одноатомными, с двумя – двухатомными, с тремя трехатомными и т.д. Например:
Спирты с двумя и более гидроксильными группами называют также многоатомными спиртами. Общая формула предельных одноатомных спиртов CnH2n+1OH или CnH2n+2O. Общая формула предельных многоатомных спиртов CnH2n+2Ox , где x – атомность спирта.
Спирты могут быть и ароматическими. Например:
бензиловый спирт
Общая формула таких одноатомных ароматических спиртов CnH2n-6O.
Однако, следует четко понимать, что производные ароматических углеводородов, в которых на гидроксильные группы заменены один или несколько атомов водорода при ароматическом ядре не относятся к спиртам. Их относят к классу фенолы. Например, это данное соединение является спиртом:
А это представляет собой фенол:
Причина, по которой фенолы не относят к спиртам, кроется в их специфических химических свойствах, сильно отличающих их от спиртов. Как легко заметить, однотомные фенолы изомерны одноатомным ароматическим спиртам, т.е. тоже имеют общую молекулярную формулу CnH2n-6O.
Ациклические углеводороды
Название алициклических соединений возникло в связи с тем, что они содержат циклы, но по свойствам близки веществам жирного ряда – алифатическим соединениям. Алициклические соединения не содержат характерных для производных бензола ароматических связей.Исключительно большая роль в изучении алицикли-ческих соединений принадлежит русским ученым. Основоположником химии алициклических соединений является В. В. Марковников.Большая группа углеводородов алициклического ряда представляет собой циклы, состоящие из нескольких метиленовых групп; эти углеводороды называются полиметиленовыми. Вторая большая группа алициклических углеводородов – производные мен-тана, к которому близки терпены.Полиметиленовые углеводороды, или циклоалканыПолиметиленовые углеводороды состоят из нескольких метиленовых групп (СН2), имеют общую формулу СпН2 п, т. е. являются изомерными олефинам. Полиметиленовые углеводороды называются также циклопарафинами, так как они, имея циклическое строение, в большинстве случаев обладают свойствами, близкими парафинам. Очень часто эти углеводороды, по предложению В. В. Марковникова, называют также нафтенами (что связано с выделением ряда их представителей из нефти).Отдельные представителиОтдельные представители полиметиленовых углеводородов обычно называются по соответствующим насыщенным углеводородам жирного ряда с приставкой цикло-. Так, простейший полиметиленовый углеводород С3Н6 называется циклопропан; углеводород С4Н8 – циклобутан, углеводород С5Н10 – цикло-пентан и т. д. Способы полученияТакие циклопарафины, как циклопентан и циклогек-сан и их алкильные замещенные, в большом количестве содержатся в некоторых видах нефти, например в кавказской. Кроме того, существует ряд способов их синтетического получения, например отщепление двух атомов галогена от галогенопроизводных углеводородов жирного ряда, содержащих атомы галогена у соответствующих различных атомов.Физические и химические свойстваЦиклопропан и циклобутан при обычной температуре – газы, циклопентан и циклооктан – жидкости, высшие представители – твердые вещества.По химическим свойствам циклопарафины близки парафинам. Это довольно стойкие в химическом отношении вещества, вступающие с галогенами в реакции замещения. Исключение составляют первые два представителя – циклопропан и циклобутан. Эти вещества, особенно циклопропан, ведут себя подобно ненасыщенным соединениям жирного ряда – они способны присоединять галогены с разрывом кольца и образованием дигалогенопроизводных жирного ряда. Различия в поведении циклопропана и циклобута-на и остальных представителей циклопарафинов объясняется теорией напряжения Байера.
Углеводороды:
Углеводороды – это органические соединения, состоящие из атомов углерода и водорода. Углеводороды служат фундаментальной основой органической химии – молекулы любых других органических соединений рассматривают как их производные.
Если в углеводороде один или несколько атомов водорода замещён на другой атом или группу атомов, называемую функциональной группой, то данное соединение называется производным углеводорода.
Атом углерода имеет 4 электрона на внешней оболочке, а потому способен образовывать четыре химические связи с другими атомами. Поэтому атом углерода является стабильным только в том случае, если все из этих связей – все четыре связи используются.
Существует огромное количество совершенно различных соединений углеводородов, которые различаются количеством атомов углерода и водорода, строением углеродного скелета и типом связей между атомами.
Большинство углеводородов в природе Земли встречаются в сырой нефти. Кроме того, основными источниками углеводородов являются природный газ, сланцевый газ, попутный нефтяной газ, горючие сланцы, уголь, торф.
Реликтовые и преобразованные углеводороды
Все углеводороды нефти делят на две группы:
- Преобразованные – утратившие особенности строения, характерные для исходных биоорганических молекул.
- Реликтовые, или хемофоссилии – те углеводороды, которые сохранили характерные особенности строения исходных молекул независимо от того, были ли эти углеводороды в исходной биомассе или сформировались позднее из других веществ.
Реликтовые углеводороды, входящие в состав нефти, подразделяются на две группы:
- изопреноидного типа – алициклического и алифатического строения, с числом циклов в одной молекуле до пяти;
- неизопреноидного – в основном алифатические соединения, имеющие н-алкильные или слаборазветвленные цепи.
Реликтов изопреноидного строения значительно больше, чем неизопреноидного.
Выделено свыше 500 реликтовых углеводородов нефти, и их число увеличивается с каждым годом.
Что такое углеводороды:
Углеводороды, также называемые карбидами водорода, представляют собой органические соединения, в состав которых входят только атомы углерода (C) и водород (H), поэтому они имеют общую формулу C x H y .
Углеводород состоит из углеродной структуры, с которой атомы водорода ковалентно связаны .
Это самое важное соединение в области органической химии. Все виды углеводородов легко окисляются, выделяя тепло
По большей части они не растворимы в воде
Все виды углеводородов легко окисляются, выделяя тепло. По большей части они не растворимы в воде.
Природные углеводороды — это химические соединения, образующиеся внутри Земли (глубиной более 150 км) под высоким давлением и достигающие областей с более низким давлением в результате геологических процессов.
Использование
Углеводороды играют огромную роль в современной жизни человечества. Нефть и газ стали очень ценными ресурсами, ведь они служат в качестве топлива и энергоносителей. Но это не единственные способы применения соединений из данного класса. Углеводороды – это буквально все, что окружает людей в быту. С помощью полимеризации удалось получить новые материалы, из которых изготавливаются разные виды пластмасс, тканей и т. д. Керосин, растворители, лакокрасочные изделия, парафины, асфальт, гудрон, битум, и это не считая основных продуктов нефтепереработки – бензина и дизельного топлива.
Значение этих веществ огромно. Как непредельные, так и предельные углеводороды – это сотни и тысячи вещей, к которым каждый человек привык и не может без них обходиться в самых простых ситуациях. Отказаться от их использования крайне сложно даже с учетом того, что запасы нефти и газа иссякнут, как предрекают аналитики. Уже сейчас человечество ведет активный поиск альтернативных источников энергии, но ни один из вариантов пока не показал такой же эффективности и универсальности, как углеводороды.
Классификация
В зависимости от качественного состава выделяют пять групп органических веществ:
- углеводороды – содержат только углерод и водород (алканы, алкены, алкины, алкадиены, циклоалканы, арены);
- азотсодержащие соединения – содержат атомы азота (нитросоединения, амины, аминокислоты);
- кислородсодержащие соединения – содержат атомы кислорода (спирты, альдегиды, кетоны, карбоновые кислоты, сложные эфиры, жиры, углеводы);
- сераорганические соединения – содержат атомы серы (некоторые аминокислоты, витамины, тиолы, сульфоксиды и другие);
-
фосфорорганические соединения – содержат атомы фосфора (фосфины, фосфонаты, фосфорнистые, фосфоновые, фосфиновые, нуклеиновые кислоты, неклеотиды).
Атом органического соединения, не являющийся водородом или углеродом, называется гетероатомом.
В зависимости от схемы строения все органические вещества делятся на две объёмные группы:
- ациклические – имеют открытую цепь атомов;
- циклические – имеют замкнутую, неоткрытую цепь атомов.
Более подробная классификация органических соединений по строению представлена в таблице.
|
Виды |
Группы |
Описание |
|
Ациклические (алифатические) |
Насыщенные (предельные) |
Алканы – содержат только простые связи |
|
Ненасыщенные (непредельные) |
– Алкены – имеют двойную связь; – алкадиены – имеют две двойные связи; – алкины – содержат тройную связь |
|
|
Циклические |
Карбоциклические |
Циклы образуют только атомы углерода. Подразделяются на алициклические и ароматические |
|
Гетероциклические |
В состав входят гетероатомы |
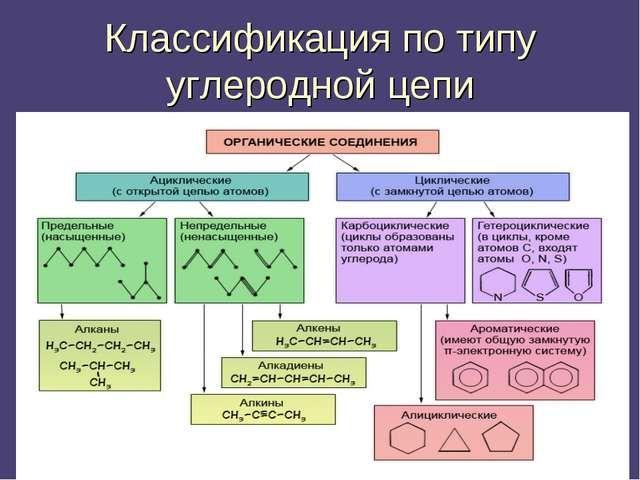
Рис. 3. Схема классификации органических веществ.
Что мы узнали?
Из урока химии 10 класса узнали об истории возникновения органической химии как науки, строении и классификации органических веществ. Развитию органической химии способствовал Бутлеров, разработав теорию химического строения. Все органические вещества содержат углерод и могут отличаться расположением атомов, качественным и количественным составом. Органические вещества классифицируются по двум признакам – составу и строению.
История открытия бензола. Строение молекулы
Бензол был открыт в начале прошлого века. Это было загадочное вещество. Многие учёные пытались разгадать его строение, объяснить его свойства, но не могли. Почему?
Дело в том, что было установлено: состав молекулы бензола выражается формулой
Задание 21.1. По составу молекулы определите, является ли это вещество предельным или непредельным углеводородом.
Если сравнить состав бензола с соответствующим алканом, легко видеть, что бензол — сильно ненасыщенное соединение. Для того чтобы превратиться в алкан, бензол должен присоединить 8 атомов (4 молекулы) водорода. Но оказалось, что бензол, присоединяя 3 молекулы водорода, превращается в вещество циклического строения:
Значит, и бензол имеет циклическое строение!
Теперь возникает вопрос: какие связи соединяют атомы углерода в молекуле бензола? В 1865 году немецкий химик Кекуле* предложил такую модель молекулы бензола:

Эта модель объясняла многие свойства бензола, но не объясняла особенности химических свойств этого соединения. Ведь если углеводород имеет три двойные связи, то он должен давать качественные реакции на двойную (кратную) связь.
Вопрос. Какие вы знаете качественные реакции на кратную связь?
Но оказалось, что бензол эти качественные реакции не даёт, т. е.
- не обесцвечивает бромную воду (при нормальных условиях);
- не обесцвечивает раствор перманганата калия.
Значит, двойных связей в молекуле бензола НЕТ!
Дальнейшие исследования показали, что в молекуле бензола существует особая, очень прочная ароматическая связь. Рассмотрим её образование на примере бензола.
Как уже было сказано, бензол имеет циклическое строение, причём атомы углерода соединены в правильный шестиугольник при помощи простых σ-связей. Такие σ-связи соединяют атомы углерода и водорода:
Вопрос. Сколько связей образовал каждый атом углерода? Сколько электронов участвует в образовании этих связей?
Поскольку каждый атом углерода имеет по четыре валентных электрона, а в образовании трёх простых σ-связей участвовало по три электрона каждого атома, — у каждого атома углерода осталось по одному «лишнему» электрону (•). Эти электроны объединяются и образуют единую электронную систему — ароматическую связь:
Задание. Соедините точки линией, не отрывая карандаш от бумаги. Что у Вас получилось? Окружность.
Ароматическая связь в молекулах обозначается кружочком:

Формулы (1) и (1а) отражают строение одного и того же вещества бензола, состава С6Н6. Записывая формулу бензола (1а), следует помнить, что:
- в вершинах этого правильного шестиугольника находится атом углерода;
- каждый атом углерода соединён с одним атомом водорода.
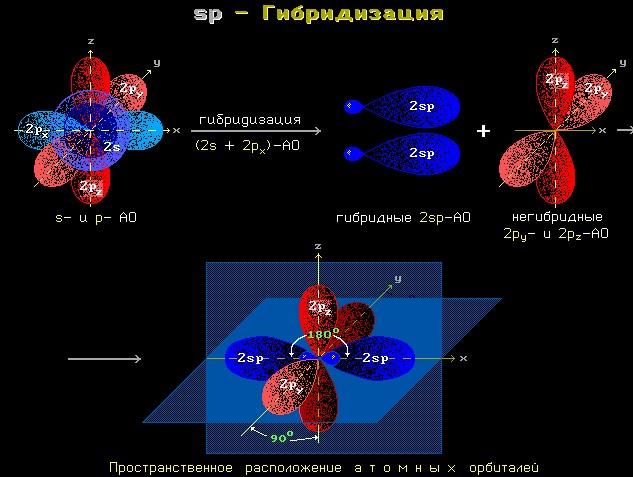
sp-Гибридизация
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:
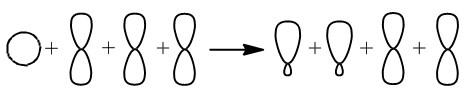
| Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180одруг к другу, что соответствует линейному строению. |
Изображение с портала orgchem.ru
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
| Например, молекула ацетилена имеет линейное строение. |
Изомерия
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:
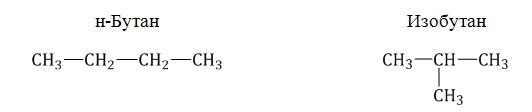
При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
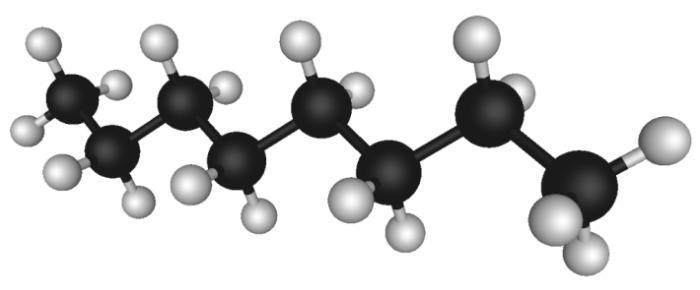
Алканы (алифатические предельные углеводороды)
Алканы – важнейшие и хорошо изученные углеводороды любой нефти. В состав нефти входят углеводороды алканы от С1 до С100. Их количество колеблется в пределах от 20 до 60 % и зависит от типа нефти. По мере возрастания молекулярной массы фракции, концентрация алканов снижается во всех типах.
Если циклические углеводороды разного строения встречаются в нефти одинаково часто, то среди алканов обычно преобладают структуры определенного строения. Причем строение, как правило, не зависит от молекулярного веса. Это значит, что в разных типах нефти присутствуют определенные гомологические ряды алканов: алканы нормального строения, монометилзамещенные с разным положением метильной группы, реже – ди- и триметилзамещенные алканы, а также тетраметилалканы изопреноидного типа. Алканы характерного строения составляют почти 90 % от всей массы алканов нефти. Этот факт позволяет хорошо изучить алканы в различных, в том числе высококипящих, фракциях нефти.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия)
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла.
Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
Классификация органических соединений
Классификацию органических веществ определяют строение углеродной цепи (углеродного скелета) и наличие и особенности строения функциональных групп.
| Углеродный скелет – это последовательность соединенных между собой атомов углерода в органической молекуле. |
| Функциональная группа – это атом или группа атомов, которая определяет принадлежность молекулы к определенному классу органических веществ и химические свойства, соответствующие данному классу веществ. |
|
Классификация органических веществ по составу |
||
| Углеводороды | Кислородсодержащие вещества | Азотсодержащие вещества |
| Состоят из атомов углерода и водорода | Содержат также атомы кислорода | Содержат также атомы азота |
Свойства бензола
Физические свойства
Бензол — это бесцветная жидкость с характерным запахом. Приятный запах некоторых ароматических соединений (аромат) дал название целому классу соединений. Бензол легче воды и не смешивается с нею. Являясь неполярным соединением, бензол хорошо растворяет неполярные соединения: жиры и масла.
Химические свойства
В молекуле бензола имеется очень прочная ароматическая связь. Поэтому в химических реакциях бензол стремится сохранить ароматическую связь. Для того чтобы понять, какие химические реакции более характерны для бензола, вспомним, как протекают реакции основных типов: замещения и присоединения.
Задание 21.3. Составьте уравнения реакций с бромом для этана и этилена. Укажите тип этих реакций.
Обратите внимание: реакции замещения происходят без изменения структуры молекулы (тип химической связи остался прежним):
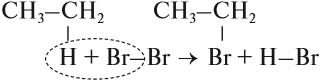
А в реакциях присоединения изменяется структура молекулы, изменяется тип химической связи:
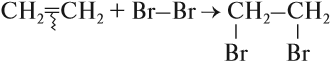
Вопрос. Какой тип химической реакции предпочтительнее для бензола: замещения или присоединения? Почему?
Поскольку в реакциях замещения тип химической связи не изменяется, то бензол и другие ароматические углеводороды преимущественно вступают в реакции замещения, так как в этих реакциях ароматическая связь (она наиболее прочная) не разрушается. Следует помнить, что при обычных условиях бензол в химические реакции не вступает.
Вопрос. Почему?
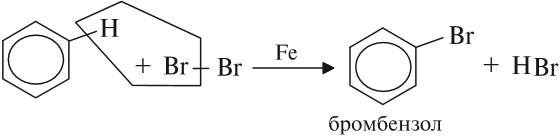
Так, реакция бромирования бензола происходит в присутствии катализатора железа:
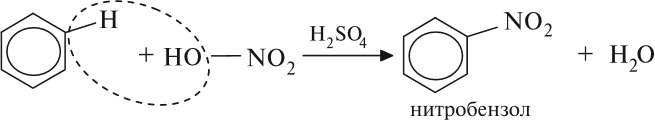
Реакция нитрования (с HNO3) происходит при нагревании в присутствии концентрированной серной кислоты:
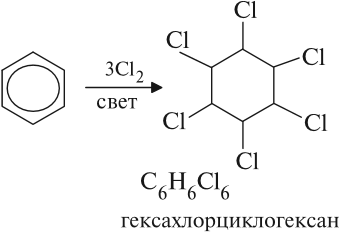
В особых условиях возможно разрушение ароматической связи, и тогда бензол вступает в реакции присоединения:
На ярком солнечном свету происходит взаимодействие бензола с хлором или бромом:
Бензол при обычных условиях не окисляется, например не обесцвечивает раствор перманганата калия. Окисление идет в особых условиях и сопровождается разрушением бензольного кольца. Бензол легко воспламеняется и горит коптящим пламенем. Пары бензола взрывоопасны. Бензол ядовит!
Задание 21.4. Составьте уравнение реакции горения бензола.

Природные источники
Как и другие полезные ископаемые, некоторые углеводороды располагаются в виде залежей и запасов в земной коре. В частности, они составляют большую часть газа и нефти. Это хорошо видно при переработке последней: в процессе выделяется огромное количество веществ, большая часть из которых относится именно к углеводородам. Газ и вовсе на 80-97% обычно состоит из метана. Кроме того, метан образуется при разложении органических отходов и останков, так что его получение не представляет серьезной проблемы.
Другие источники углеводородов – лаборатории. Те вещества, которые не встречаются в природе, могут быть синтезированы из других соединений с помощью химических реакций.
Гетероциклические соединения
Гетероциклические соединения — это органические соединения, молекулы которых содержат циклы, в образовании которых кроме атома углерода принимают участие и атомы других элементов (гетероатомы).
К гетероатомам относят атомы азота, кислорода, серы, кремния, фосфора, селена, бора и некоторых других элементов.
Гетероциклические соединения широко распространены как в животном, так и в растительном мире. Очень многие биологически важные вещества содержат в своем составе гетероциклические фрагменты.
Гетероциклические соединения играют большую роль в жизнедеятельности организмов и имеют важное физиологическое значение (ДНК, РНК, хлорофилл, алкалоиды, ряд витаминов, антибиотиков)
Классификация гетероциклических соединений
Гетероциклические соединения классифицируют согласно следующим структурным признакам:
- размеру цикла (числу атомов в цикле);
- по природе гетероатома;
- по числу гетероатомов в цикле;
- по степени ненасыщенности (насыщенные и ненасыщенные).
1. В зависимости от числа атомов в цикле гетероциклические соединения подразделяют на трех- , четырех- , пяти- , шести- и семичленные.
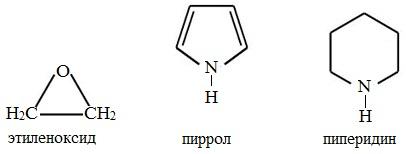
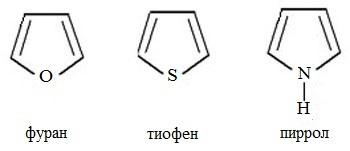
2. По природе гетероатома наиболее распространены гетероциклы, в состав которых входят атомы азота, кислорода или серы.
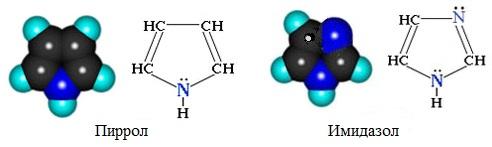
Простейшие пятичленные гетероциклы с одним гетероатомом – фуран, тиофен и пиррол:
3. По числу гетероатомов, входящих в цикл, наиболее распространены гетероциклы с
– одним гетероатомом:
– двумя гетероатомами:
4. По степени насыщенности гетероциклы могут быть насыщенными, ненасыщенными и ароматическими.
Насыщенные
Ненасыщенные
Ароматические
Особый интерес представляют непредельные гетероциклические соединения, которые удовлетворяют условиям ароматичности. Они имеют плоское строение и замкнутую систему π-электронов.
Наиболее разнообразны и хорошо изучены ароматические азотсодержащие гетероциклические соединения.
По некоторым свойствам гетероциклы сходны с соответствующими алифатическими и карбоциклическими соединениями.
Аналогично карбоциклическим соединениям, наиболее устойчивыми являются пяти- и шестичленные гетероциклы.
Пятичленные гетероциклы
а) с одним атомом азота
б) с двумя атомами азота
Эти гетероциклы имеют плоское строение и единую π-систему из шести электронов (по одному от четырех атомов углерода и пара электронов – от атома кислорода, серы или азота).
В этом проявляется сходство данных соединений с бензолом: пятичленные гетероциклы обладают ароматическим характером и склонны к реакциям замещения.
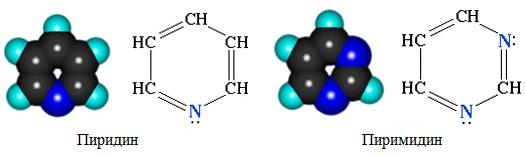
а) с одним атомом азота (пиридин и его производные)
б) с двумя атомами азота (пиримидин и его производные)
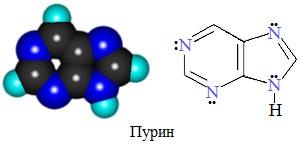
Конденсированные (бициклические) гетероциклы (пурин и его производные)
Большое значение имеют гетероциклы, конденсированные с бензольным кольцом или с другим гетероциклом.
При названии гетероциклов широко используются тривиальные названия: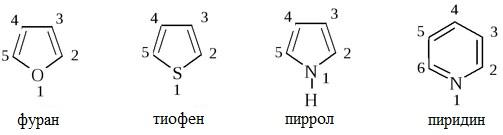
Гетероциклические соединения, как и бензол, более склонны к реакциям замещения, чем к реакциям присоединения. Они вступают в типичные для бензола реакции электрофильного замещения, устойчивы по отношению к восстановителям и окислителям.
Эти особенности в химическом поведении определяются наличием в их кольцах электронного секстета. Благодаря сопряжению, связи выравниваются, и кольцо становится плоским. Однако стабильность секстетов π-электронов в молекуле бензола и в молекулах гетероциклов различна.
Рубрики: Гетероциклические соединения
Изопреноидные алканы
К изопреноидным алканам относят разветвленные углеводороды с правильным чередованием метильных групп. Например, 2,6,10,14-тетраметилпентадекан или 2,6,10-триметилгексадекан. Изопреноидные алканы и алканы с неразветвленной цепью составляют преобладающую массу биологического исходного материала нефти. Конечно, вариантов изопреноидных углеводородов гораздо больше.

Для изопреноидов характерна гомологичность и неравновесность, то есть для разных нефтей характерен свой набор этих соединений. Гомологичность является следствием разрушения более высокомолекулярных источников. В изопреноидных алканах можно выявить «провалы» в концентрациях каких-либо гомологов. Это следствие невозможности разрыва их цепи (образования этого гомолога) в том месте, где находятся метильные заместители. Эту особенность используют для определения источников образования изопреноидов.
Азотсодержащие органические вещества
Азотсодержащие вещества можно также разделить на классы по наличию определенных функциональных групп.
- амины – содержат группы –NН2, –NH–, либо -N< ,
- нитрилы (группа –СºN),
- азотистые гетероциклы.
Некоторые органические вещества содержат и азот, и кислород.
К ним относятся:
- нитросоединения –NO2
- амиды –CONH2,
- аминокислоты – полифункциональные соединения, которые содержат и карбоксильную группу –COOH, и аминогруппу –NH2
| Азотсодержащие вещества | |||||
| Амины | Нитрилы | Нитросоединения | Амиды | Аминокислоты | Гетероциклы |
|
-NH2
-NH- -N< |
-C≡N | R-NO2 | R-C(NH2)=O | -NH2, -COOH | |
|
Метиламин
CH3-NH2 |
Нитрил уксусной кислоты
CH3-C≡N |
Нитрометан
CH3-NO2 |
Амид уксусной кислоты
CH3-C(NH2)=O |
Аминоуксусная кислота
CH2(NH2)-COOH |
Пиррол |
Методы исследования углеводородного состава нефти
Для технических целей достаточно установление состава нефти по содержанию в ней отдельных классов углеводородов. Фракционный состав нефти важен для выбора направления переработки нефти.
С целью определения группового состава нефти применяют различные методы:
- Химические подразумевают проведение реакции (нитрования или сульфирования) взаимодействия реагента с определенным классом углеводородов (алкенами или аренами). По изменению объема или количеству получившихся продуктов реакции судят о содержании определяемого класса углеводородов.
- Физико-химические включают экстракцию и адсорбцию. Так проводят экстрагирование аренов диоксидом серы, анилином или диметилсульфатом, с последующей адсорбцией этих углеводородов на силикагеле.
- Физические включают определение оптических свойств.
- Комбинированные — наиболее точные и самые распространенные. Сочетают в себе два каких-либо метода. Например, удаление аренов химическим или физико-химическим методом и измерение физических свойств нефти до и после их удаления.
Для научных целей важно определить точно, какие углеводороды в нефти содержатся или преобладают. Для выявления отдельных молекул углеводородов используют газожидкостную хроматографию с использованием капиллярных колонок и установления температуры, хромато-масспектрометрию с компьютерной обработкой и построением хроматограмм по отдельным характеристическим фрагментным ионам (масс-фрагментография или масс-хроматография)
Используются также спектры ЯМР на ядрах 13С
Для выявления отдельных молекул углеводородов используют газожидкостную хроматографию с использованием капиллярных колонок и установления температуры, хромато-масспектрометрию с компьютерной обработкой и построением хроматограмм по отдельным характеристическим фрагментным ионам (масс-фрагментография или масс-хроматография). Используются также спектры ЯМР на ядрах 13С.
Современные схемы анализа состава углеводородов нефти включают предварительное разделение на две или три фракции с разными температурами кипения. После этого каждую из фракций разделяют на насыщенные (парафиново-нафтеновые) и ароматические углеводороды с помощью жидкостной хроматографии на силикагеле. Далее ароматические углеводороды следует разделить на моно-, би- и полиароматические с помощью жидкостной хроматографии с использованием оксида алюминия.
Техническое значение углеводородного состава нефти
Состав веществ существенно влияет на показатели качества нефти.
1. Парафины:
- Нормальные парафины (неразветвленные) обладают низким октановым числом и высокими температурами застывания. Поэтому в процессе переработки их превращают в углеводороды других групп.
- Изопарафины (разветвленные) обладают высоким октановым числом, то есть высокими антидетонационными свойствами (изооктан – эталонное соединение с октановым числом 100), а также низкими, по сравнению с нормальными парафинами, температурами застывания.
2. Нафтены (циклопарафины) наряду с изопарафинами положительно влияют на качество дизельного топлива и смазочных масел. Их высокое содержание в тяжелой бензиновой фракции приводит к высокому выходу и высокому октановому числу продуктов.
3. Ароматические углеводороды ухудшают экологические свойства топлива, но обладают высоким октановым числом. Поэтому при переработке нефти другие группы углеводородов превращают в ароматические, но количество их, в первую очередь бензола, в топливе строго регламентируется.
Углеводороды:
Углеводороды – это органические соединения, состоящие из атомов углерода и водорода. Углеводороды служат фундаментальной основой органической химии – молекулы любых других органических соединений рассматривают как их производные.
Если в углеводороде один или несколько атомов водорода замещён на другой атом или группу атомов, называемую функциональной группой, то данное соединение называется производным углеводорода.
Атом углерода имеет 4 электрона на внешней оболочке, а потому способен образовывать четыре химические связи с другими атомами. Поэтому атом углерода является стабильным только в том случае, если все из этих связей – все четыре связи используются.
Существует огромное количество совершенно различных соединений углеводородов, которые различаются количеством атомов углерода и водорода, строением углеродного скелета и типом связей между атомами.
Большинство углеводородов в природе Земли встречаются в сырой нефти. Кроме того, основными источниками углеводородов являются природный газ, сланцевый газ, попутный нефтяной газ, горючие сланцы, уголь, торф.
Классификация
Углерод образует четыре связи, а водород – одну. Но это не значит, что их соотношение всегда равно 1 к 4. Дело в том, что между атомами углерода могут быть не только одинарные, но и двойные, а также тройные связи. По этому критерию различают классы углеводородов. В первом случае эти вещества называются предельными (или алканами), а во втором – ненасыщенными или непредельными (алкенами и алкинами для двух и трех связей соответственно).
Еще одна классификация предусматривает рассмотрение молекулы. В этом случае различают алифатические углеводороды, структура которых линейна, и карбоциклические, в виде замкнутой цепи. Последние в свою очередь делятся на алициклические и ароматические.

Помимо этого, углеводороды часто подвергаются полимеризации – процессу присоединения одинаковых молекул одна к другой. В результате получается совершенно новый материал, не похожий на базовый. Примером может служить полиэтилен, получающийся из просто этилена. Это возможно только когда речь идет о ненасыщенных углеводородах.
Структуры, которые также относятся к классу непредельных, могут с помощью своих свободных радикалов присоединять и новые атомы, отличные от водорода. В этом случае получаются другие органические вещества: спирты, амины, кетоны, эфиры, белки и т. д. Но это уже совершенно отдельные темы в химии.

5.1. Средства измерений и вспомогательные устройства
|
5.1.1. Хроматограф лабораторный |
|
|
— пламенно-ионизационным |
|
|
— стальной насадочной колонкой |
|
|
5.1.2. Весы лабораторные общего |
|
|
5.1.3. Гири общего назначения |
|
|
5.1.4. Лупа измерительная |
ГОСТ 8309 |
|
5.1.5. Секундомер |
ТУ 25-1819.0021-90 |
|
5.1.6. Мыльно-пенный измеритель |
|
|
5.1.7. Электрошкаф лабораторный, |
|
|
5.1.8. Шприц цельностеклянный |
ТУ 64-1-1279-75 |
|
5.1.9. Линейка измерительная |
|
|
5.1.10. Электроплитка для водяной |
|
|
5.1.11. Цилиндр мерный 1-50-2 или |
|
|
5.1.12. Чашка выпарительная |
|
|
5.1.13. Стакан В-1-50 или В-1-100 |
|
|
5.1.14. Комплект поверочных |
Допускается применение других
средств измерения, устройств и посуды, метрологические и технические
характеристики которых не хуже указанных.